§ 4. Структура и свойства белков
Белки *(протеины)* — это полипептиды, в состав молекул которых входит множество остатков аминокислот (до нескольких тысяч). *Белки — нерегулярные биополимеры.* Они различаются количеством аминокислотных звеньев, их составом и последовательностью расположения. При этом каждый белок имеет особый, присущий только ему порядок чередования аминокислот.
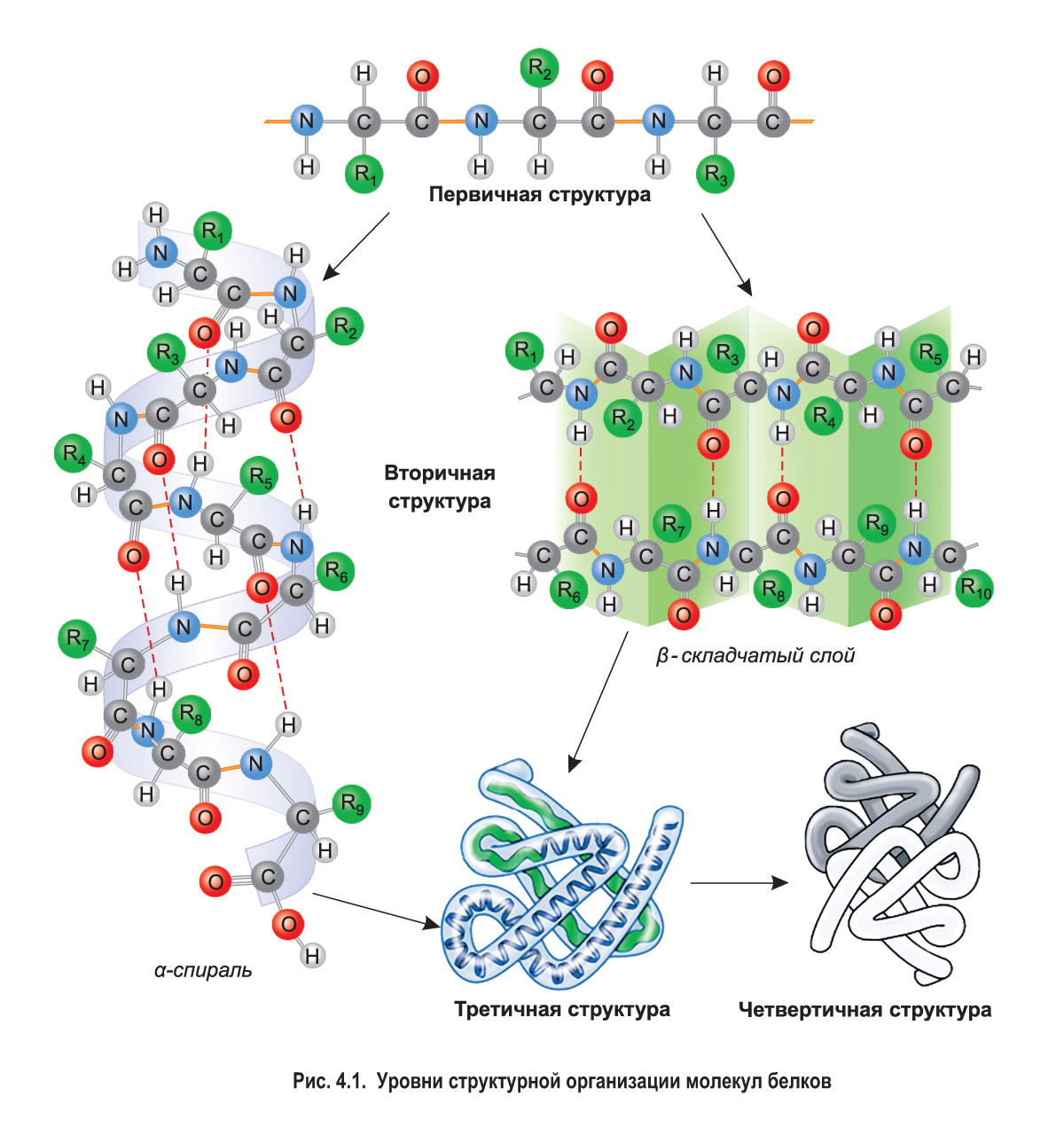
Уровни структурной организации белковых молекул. Для того чтобы белок мог выполнять свою биологическую функцию, его молекула должна иметь определенную пространственную конфигурацию. Различают четыре основных уровня организации белковых молекул — первичную, вторичную, третичную и четвертичную структуры (рис. 4.1).
Первичная структура белка — это строго определенная последовательность аминокислотных остатков в линейной полипептидной цепи. Каждый белок обладает уникальной первичной структурой. Ее существование обусловлено наличием прочных пептидных связей между остатками аминокислот. Все последующие, более сложные структуры формируются на основе первичной. Поэтому изменение первичной структуры (например, замена одних аминокислотных остатков на другие) приводит к изменению формы молекулы, свойств и функций белка.
Вторичная структура белка формируется за счет образования многочисленных водородных связей между атомами водорода NH-групп и атомами кислорода CO-групп разных аминокислотных остатков. Несмотря на то что эти связи слабее ковалентных, их количество обеспечивает стабильность вторичной структуры.
Чаще всего водородные связи возникают внутри одной полипептидной цепи между близко расположенными остатками аминокислот, что приводит к закручиванию этой цепи в так называемую α-спираль.
Иногда водородные связи возникают между относительно удаленными друг от друга участками полипептидной цепи (или нескольких разных цепей). *Данные участки могут располагаться параллельно (если полипептидные цепи идут в одном направлении, например, от N-конца к C-концу) либо антипараллельно (если цепи имеют противоположное направление: одна идет от N-конца к С-концу, а соседняя наоборот).* При этом формируется складчатая структура, напоминающая гармошку. Такой тип вторичной структуры получил название β-складчатый слой (см. рис. 4.1).
Лишь некоторые белки имеют вторичную структуру, представленную только α-спиралью или β-складчатым слоем. Например, полностью α-спиральную конфигурацию имеет кератин — основной белок волос и ногтей человека, а вторичная структура фиброина (белка натурального шелка) представлена исключительно β-складчатым слоем. В структуре многих белков одни участки имеют вид α-спирали, а другие — β-складчатого слоя.
*α-спиральные и β-структурные участки белковой молекулы могут взаимодействовать друг с другом и между собой, образуя упорядоченные структуры (ансамбли). Например, α-спиральные фрагменты могут объединяться в двойные или тройные спирали. На основе β-участков часто образуются структуры, имеющие вид шпилек, арок, зигзагов и др. Участки, имеющие α- и β- строение, могут формировать ансамбли состава αβ, βαβ, βαβαβ и т. п. Эти пространственные конфигурации представляют собой так называемую сверхвторичную структуру белка.
Ансамбли сверхвторичной структуры являются основой для формирования в молекулах белков доменов. Это структурно и функционально обособленные области, соединенные друг с другом короткими фрагментами полипептидной цепи — шарнирными участками.
Например, молекулы мембранных белков-рецепторов чаще всего состоят из трех доменов. Надмембранный домен обеспечивает прием внешних сигналов, внутримембранный закрепляет белок в мембране, подмембранный осуществляет передачу сигнала внутрь клетки. Другим примером может служить сывороточный альбумин — белок плазмы крови, способный связываться с высшими карбоновыми кислотами, билирубином, некоторыми токсинами и другими соединениями и доставлять их в те или иные органы. Молекула этого белка содержит три домена, каждый из которых отвечает за избирательное связывание с определенными веществами.*
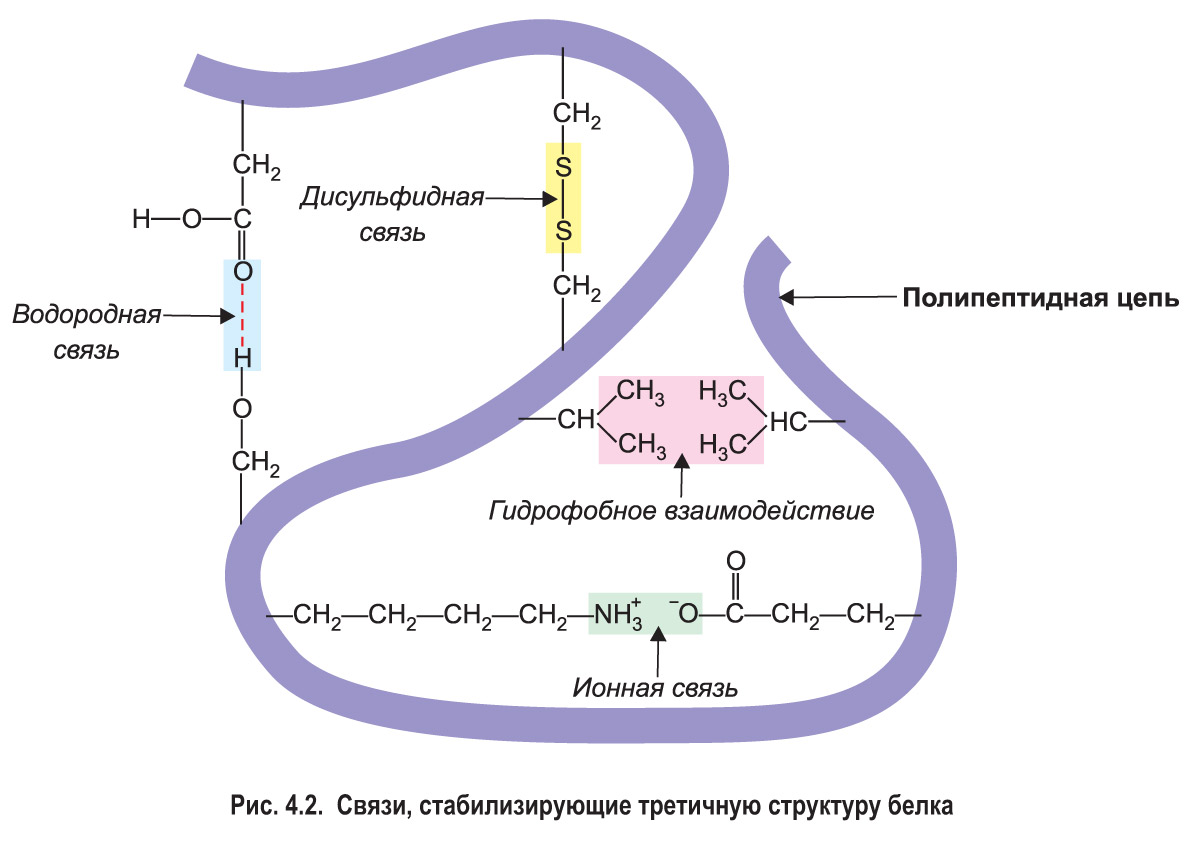
Формирование третичной структуры обеспечивают водородные, ионные и другие связи, возникающие между разными группами атомов белковой молекулы. В водной среде молекула белка особым образом укладывается в пространстве, приобретая компактную форму. При этом гидрофобные аминокислотные радикалы погружаются внутрь белковой молекулы и притягиваются друг к другу — такое притяжение называется гидрофобным взаимодействием. Гидрофильные участки полипептида, наоборот, располагаются на поверхности и взаимодействуют с молекулами воды. У многих белков в образовании третичной структуры участвуют ковалентные дисульфидные связи (S—S связи), которые возникают между остатками аминокислоты цистеина (рис. 4.2). Третичная структура каждого белка имеет особую, неповторимую пространственную конфигурацию.
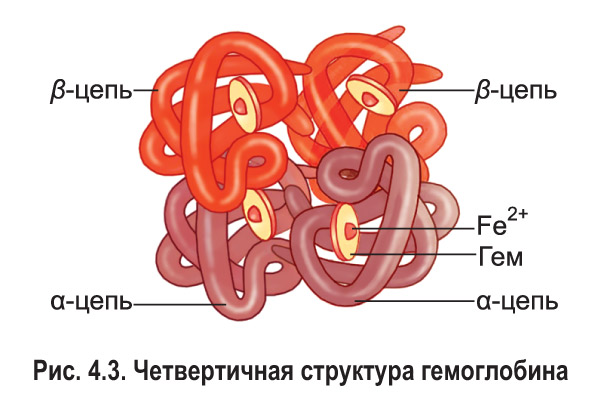
Многие белки способны выполнять свои биологические функции, обладая третичной структурой. Но некоторым белкам для этого необходимо объединение в единый комплекс двух или более молекул, имеющих третичную структуру. Так возникает четвертичная структура белка. Молекулы, входящие в ее состав *(их называют субъединицами или протомерами)*, могут быть одинаковыми или разными. Они удерживаются вместе благодаря различным видам нековалентных связей — водородным, ионным, гидрофобным взаимодействиям и др. В некоторых белках, например иммуноглобулинах, к множеству таких связей добавляются несколько ковалентных дисульфидных. Примером белка, имеющего четвертичную структуру, может служить гемоглобин (рис. 4.3).
В состав гемоглобина человека входят четыре полипептидные цепи двух разных типов: две α-цепи (содержащие по 141 аминокислотному остатку) и две β-цепи (по 146 остатков). Каждая цепь формирует специальный гидрофобный карман, в котором располагается компонент небелковой природы — гем. Центральную часть гема занимает ион Fe2+.