§ 4-1. Функции белков
Белки выполняют разнообразные биологические функции — структурную, транспортную, регуляторную и многие другие. При этом одной из самых важных функций белков в живых организмах является каталитическая (ферментативная).
Ферменты. Из курса химии вы знаете, что вещества, повышающие скорость химических реакций, называются катализаторами. Ферменты *(энзимы)* — это белки, которые выполняют функции биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Без их участия биохимические процессы происходили бы слишком медленно или не происходили бы вообще. Ферменты осуществляют расщепление и синтез различных соединений, обеспечивая протекание обмена веществ. Практически все процессы жизнедеятельности обусловлены ферментативными реакциями.
*Ферменты представляют собой глобулярные белки третичной или четвертичной структуры. В состав молекул многих ферментов кроме полипептидного компонента (апофермента) входят также вещества небелковой природы — кофакторы. В роли кофакторов могут выступать неорганические ионы (Mg2+, Fe2+, Zn2+ и др.) или коферменты — низкомолекулярные органические соединения. Чаще всего коферментами являются витамины и их производные.*
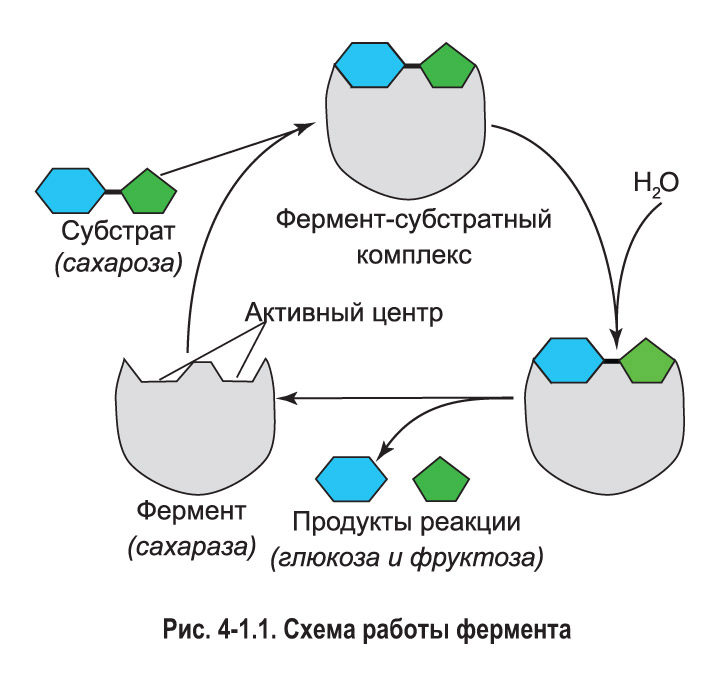 Ферменты ускоряют химические реакции за счет тесного взаимодействия с молекулами субстратов — исходных реагирующих веществ. С субстратом (или субстратами) взаимодействует не вся молекула фермента, а лишь небольшой ее участок — активный центр. Чаще всего он образован несколькими аминокислотными остатками. Активный центр каждого фермента имеет особую форму и химическое строение, поэтому с ним могут связываться лишь определенные субстраты (рис. 4-1.1).
Ферменты ускоряют химические реакции за счет тесного взаимодействия с молекулами субстратов — исходных реагирующих веществ. С субстратом (или субстратами) взаимодействует не вся молекула фермента, а лишь небольшой ее участок — активный центр. Чаще всего он образован несколькими аминокислотными остатками. Активный центр каждого фермента имеет особую форму и химическое строение, поэтому с ним могут связываться лишь определенные субстраты (рис. 4-1.1).
Присоединение субстрата вызывает небольшие изменения конфигурации активного центра — такие, чтобы максимально соответствовать субстрату. Функционально активные группы фермента, за счет которых будет протекать реакция, наиболее благоприятным образом располагаются в пространстве. Образно говоря, активный центр подстраивается под субстрат как перчатка, которую надевают на руку.
В результате присоединения к активному центру молекула субстрата особым образом располагается в пространстве, и в ее структуре ослабляются определенные химические связи. Реакционная способность субстрата возрастает. Поэтому, по сравнению с некатализируемой реакцией, ферментативное превращение субстрата в продукт (или продукты) происходит с меньшими затратами энергии и гораздо большей скоростью. Образовавшиеся продукты отделяются от активного центра. После этого он может принимать новые молекулы субстрата.
Сходство ферментов с обычными химическими катализаторами проявляется в том, что и те и другие увеличивают скорость реакции, но при этом не расходуются и могут использоваться многократно.
В отличие от обычных химических катализаторов ферменты обладают специфичностью, т. е. каждый фермент ускоряет только одну определенную реакцию или действует только на один тип связи. Эта особенность объясняется соответствием активного центра фермента определенным субстратам. Ферменты работают гораздо быстрее (они ускоряют реакции в миллионы и миллиарды раз, а неорганические катализаторы — в сотни и тысячи раз), поэтому даже в очень малых концентрациях ферменты обеспечивают интенсивное протекание катализируемых реакций.
В ходе некоторых окислительно-восстановительных процессов, протекающих в живых организмах, образуется токсичное для клеток соединение — пероксид водорода (Н2О2). Без участия катализаторов его расщепление идет очень медленно: 2H2O2 → 2H2O + O2. Вы знаете, что в лаборатории при проведении этой реакции обычно используют неорганический катализатор, например оксид марганца (MnO2). В его присутствии разложение Н2О2 происходит значительно быстрее. В живых организмах под действием фермента каталазы этот процесс протекает с удивительно высокой скоростью: одна молекула каталазы расщепляет за 1 с около 200 000 молекул H2O2!
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне рН, температуры и других факторов. Например, фермент желудочного сока пепсин активен только в кислой среде, а ферменты слюны амилаза и мальтаза — в слабощелочной. В диапазоне 0—40 °С повышение температуры приводит к ускорению ферментативных реакций. Но при дальнейшем увеличении температуры реакции, катализируемые большинством ферментов, замедляются, а затем вовсе прекращаются. Значительное повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
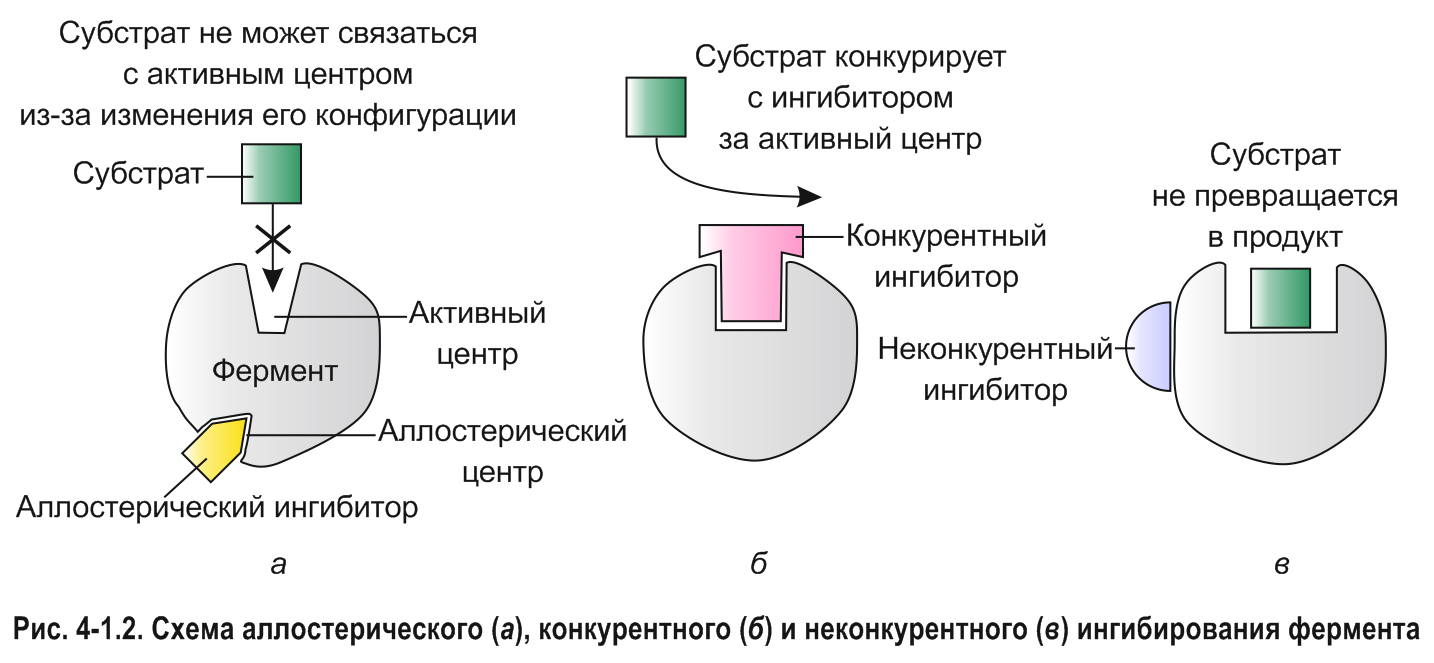
*Существуют ферменты, которые, кроме активного центра, имеют один или несколько регуляторных (аллостерических) центров. С активным или регуляторным центром, либо с другими участками молекулы фермента могут связываться определенные вещества, влияющие на его активность. Вещества, повышающие скорость ферментативной реакции, называются активаторами, снижающие или блокирующие активность фермента — ингибиторами.
Ингибиторы, которые связываются с регуляторным (аллостерическим) центром, вызывают изменения пространственной конфигурации (конформации) фермента, приводящие к уменьшению его активности. Такой тип ингибирования называется аллостерическим (рис. 4-1.2, а).
Некоторые соединения, по структуре сходные с субстратом, могут связываться с активным центром фермента, но не способны подвергаться ферментативному превращению. Такие вещества препятствуют доступу субстрата в активный центр, тем самым снижая скорость ферментативной реакции. Поскольку молекулы субстрата и ингибитора конкурируют за активный центр, данный тип ингибирования назван конкурентным (рис. 4-1.2, б).
Известно также неконкурентное ингибирование, при котором ингибиторы присоединяются к молекуле фермента вне активного и регуляторного центров. Неконкурентные ингибиторы не мешают связыванию ферментов с субстратами, но вызывают такие изменения структуры, которые не позволяют ферменту превращать субстрат в продукт (рис. 4-1.2, в). Примером могут служить цианид-ионы (CN–). Они подавляют активность ряда ферментов за счет связывания с ионами металлов, выполняющими роль кофакторов.*
*Ферменты широко используются в пищевой промышленности (при производстве сыров и других кисломолочных продуктов, соков, чая, овощных и фруктовых пюре, в хлебопечении, пивоварении, виноделии, для обработки мяса и т. п.). Их также применяют в сельском хозяйстве для получения кормов, в медицине для диагностики и лечения заболеваний, в текстильной и кожевенной промышленности для обработки тканей, кожи и меха, в производстве синтетических моющих средств и др.*
Кроме каталитической, белки выполняют и другие важные функции (таблица 4-1.1).
Таблица 4-1.1. Основные функции белков в живых организмах
|
Функция |
Пояснение и примеры |
|
Каталитическая (ферментативная) |
Являются биологическими катализаторами — повышают скорость протекания биохимических реакций, обеспечивая расщепление, синтез и внутримолекулярную перестройку различных соединений. Например, пищеварительные ферменты липазы ускоряют расщепление липидов, амилаза и мальтаза — углеводов, пепсин и трипсин — белков. *Рибулозодифосфат-карбоксилаза обеспечивает связывание углекислого газа в процессе фотосинтеза. Удвоение молекул ДНК происходит под действием фермента ДНК-полимеразы, образование РНК — под действием РНК-полимеразы* |
|
Структурная |
Входят в состав всех компонентов клеток и различных внеклеточных структур. Например, кератин — основной компонент волос, ногтей, когтей, копыт, рогов, перьев. Эластин входит в состав стенок артерий, связок и др., коллаген — в состав кожи, сухожилий, костной, хрящевой и других тканей. *Склеротин является компонентом наружного скелета насекомых и паукообразных. Фиброин составляет основу коконов насекомых* |
|
Транспортная |
Переносят различные вещества от одних клеток и тканей к другим, обеспечивают их поступление в клетки, выведение из клеток, а также процессы внутриклеточного транспорта. Например, дыхательный пигмент гемоглобин переносит кислород и углекислый газ в крови позвоночных животных, а у многих моллюсков и ряда членистоногих эту функцию выполняет гемоцианин. *Глобулины плазмы крови транспортируют гормоны и ионы металлов (например, трансферрин — ионы железа, церулоплазмин — ионы меди), альбумины переносят высшие карбоновые кислоты и некоторые другие вещества* |
|
Сократительная (двигательная) |
Принимают участие во всех видах движения, к которым способны клетки и организмы. Например, белки актин и миозин обеспечивают сократимость гладкой и поперечнополосатой мышечных тканей. *В основе движения жгутиков и ресничек эукариотических клеток лежит скольжение друг относительно друга микротрубочек, входящих в их состав. Оно обеспечивается взаимодействием белков тубулина и динеина* |
|
Регуляторная |
Регулируют протекание различных физиологических процессов. Например, гормоны инсулин и глюкагон регулируют уровень глюкозы в крови. Процессы роста и физического развития человека протекают под контролем гормона соматотропина. *Другие тропные гормоны, секретируемые передней и средней долями гипофиза, также представляют собой полипептиды. Например, тиреотропин, стимулирующий деятельность щитовидной железы, гонадотропины, регулирующие работу половых желез, пролактин, контролирующий развитие и функционирование молочных желез и т. п. Гормон щитовидной железы кальцитонин и паратгормон, вырабатываемый паращитовидными железами, регулируют содержание ионов Са2+ в организме* |
|
Сигнальная (рецепторная) |
Некоторые мембранные белки в ответ на действие определенных химических веществ или раздражителей иной природы изменяют свою конфигурацию. Это приводит к изменению протекания тех или иных внутриклеточных процессов. Таким образом, рецепторные белки обеспечивают прием внешних сигналов и ответные реакции клеток на эти сигналы. Например, зрительные пигменты глаза — родопсин (содержится в палочках) и йодопсины (в колбочках) — обеспечивают восприятие света фоторецепторными клетками, их возбуждение и запуск нервного импульса. *Другими примерами могут служить мембранные рецепторы, которые связывают молекулы гормонов, нейромедиаторов и др. Светочувствительный белок фитохром обеспечивает реакцию растений на изменение длины светового дня (фотопериодизм). Он играет важную роль в регуляции цветения, прорастания семян, формирования листьев и т. д.* |
|
Защитная |
Тромбопластин, тромбин и фибриноген обеспечивают свертывание крови, защищая организм от кровопотери. Иммуноглобулины (антитела) участвуют в иммунном ответе организма на чужеродные объекты — антигены. Лизоцим, содержащийся в слюне, слезной жидкости и т. д, обладает антибактериальными свойствами. *От бактериальных и других чужеродных клеток организм защищают также белки системы комплемента, постоянно присутствующие в крови. Интерфероны обладают противовирусным действием* |
|
Токсическая |
Токсины, выделяемые многими бактериями (дифтерийный, ботулиновый, столбнячный, холерный и др.) по химической природе являются белками. Действующие вещества в составе ядов змей, некоторых пауков, скорпионов и насекомых также представляют собой белки |
|
Запасающая |
Запасаются в качестве источника аминокислот, например, резервные белки, которые откладываются в семенах растений *(легумин, запасающийся в семенах бобовых и др.)*, или обеспечивают запасание других веществ. Так, миоглобин играет важную роль в создании кислородного запаса в мышечных волокнах. *Ферритин выполняет роль основного внутриклеточного депо железа у человека и животных* |
|
Энергетическая |
После гидролиза до аминокислот могут подвергаться дальнейшему расщеплению и окислению с высвобождением энергии. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки используются в качестве источника энергии лишь в крайних случаях, когда истощаются запасы углеводов и жиров |
*Натуральный шелк, получаемый из коконов шелкопряда, на 75 % состоит из фиброина и на 25 % из серицина. Фиброин — нерастворимый белок, вторичная структура которого (β-складчатый слой) обусловливает прочность шелка. Волокна шелка образованы фиброиновыми нитями. Снаружи они покрыты клейким водорастворимым серицином, который при производстве тканей удаляется. Шелковая нить имеет треугольное сечение и, как призма, преломляет свет, что вызывает красивое переливание и блеск. Шелк использовался для изготовления тканей еще в 4-ом тысячелетии до н. э. Шелковое волокно применяют в качестве шовного материала в хирургии.*
У пауков основу паутины составляет белок спидроин. Секрет паутинных желез выводится наружу в жидком виде. После этого структура спидроина изменяется, и он затвердевает в виде тонких нитей. В их составе участки β-складчатого слоя чередуются с эластичными полипептидными связками. Благодаря этому паутина обладает одновременно высокой прочностью и эластичностью. Она разрывается лишь при растяжении в 5 раз. По прочности паутина сопоставима со сталью, но при этом ее плотность в 6 раз меньше, чем у стали. Если бы паук создал нить длиной в земной экватор, она имела бы массу менее 500 г.