§ 4. Структура и свойства белков
| Сайт: | Профильное обучение |
| Курс: | Биология. 11 класс |
| Книга: | § 4. Структура и свойства белков |
| Напечатано:: | Гость |
| Дата: | Понедельник, 18 Август 2025, 11:00 |
Белки *(протеины)* — это полипептиды, в состав молекул которых входит множество остатков аминокислот (до нескольких тысяч). *Белки — нерегулярные биополимеры.* Они различаются количеством аминокислотных звеньев, их составом и последовательностью расположения. При этом каждый белок имеет особый, присущий только ему порядок чередования аминокислот.
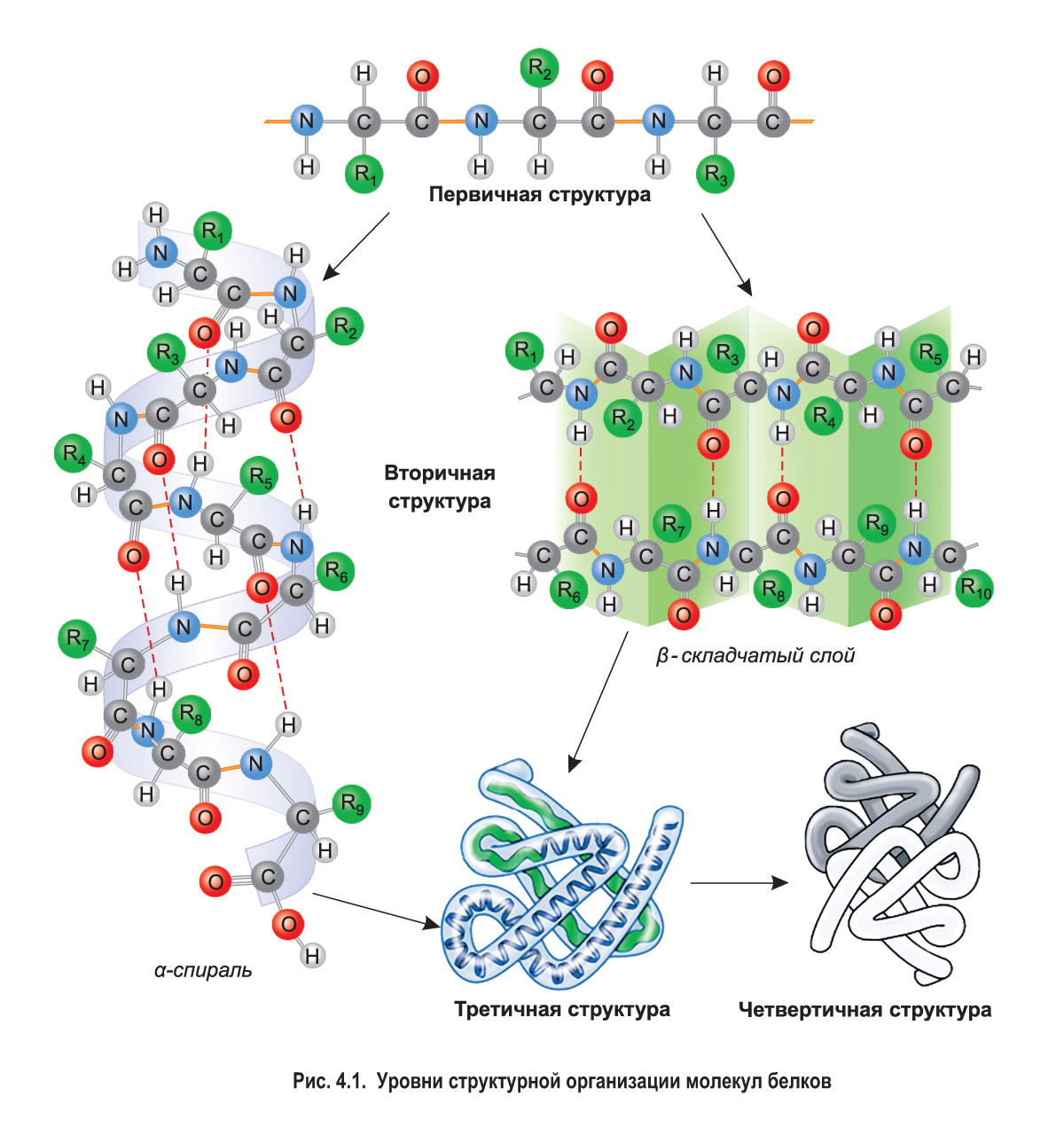
Уровни структурной организации белковых молекул. Для того чтобы белок мог выполнять свою биологическую функцию, его молекула должна иметь определенную пространственную конфигурацию. Различают четыре основных уровня организации белковых молекул — первичную, вторичную, третичную и четвертичную структуры (рис. 4.1).
Первичная структура белка — это строго определенная последовательность аминокислотных остатков в линейной полипептидной цепи. Каждый белок обладает уникальной первичной структурой. Ее существование обусловлено наличием прочных пептидных связей между остатками аминокислот. Все последующие, более сложные структуры формируются на основе первичной. Поэтому изменение первичной структуры (например, замена одних аминокислотных остатков на другие) приводит к изменению формы молекулы, свойств и функций белка.
Вторичная структура белка формируется за счет образования многочисленных водородных связей между атомами водорода NH-групп и атомами кислорода CO-групп разных аминокислотных остатков. Несмотря на то что эти связи слабее ковалентных, их количество обеспечивает стабильность вторичной структуры.
Чаще всего водородные связи возникают внутри одной полипептидной цепи между близко расположенными остатками аминокислот, что приводит к закручиванию этой цепи в так называемую α-спираль.
Иногда водородные связи возникают между относительно удаленными друг от друга участками полипептидной цепи (или нескольких разных цепей). *Данные участки могут располагаться параллельно (если полипептидные цепи идут в одном направлении, например, от N-конца к C-концу) либо антипараллельно (если цепи имеют противоположное направление: одна идет от N-конца к С-концу, а соседняя наоборот).* При этом формируется складчатая структура, напоминающая гармошку. Такой тип вторичной структуры получил название β-складчатый слой (см. рис. 4.1).
Лишь некоторые белки имеют вторичную структуру, представленную только α-спиралью или β-складчатым слоем. Например, полностью α-спиральную конфигурацию имеет кератин — основной белок волос и ногтей человека, а вторичная структура фиброина (белка натурального шелка) представлена исключительно β-складчатым слоем. В структуре многих белков одни участки имеют вид α-спирали, а другие — β-складчатого слоя.
*α-спиральные и β-структурные участки белковой молекулы могут взаимодействовать друг с другом и между собой, образуя упорядоченные структуры (ансамбли). Например, α-спиральные фрагменты могут объединяться в двойные или тройные спирали. На основе β-участков часто образуются структуры, имеющие вид шпилек, арок, зигзагов и др. Участки, имеющие α- и β- строение, могут формировать ансамбли состава αβ, βαβ, βαβαβ и т. п. Эти пространственные конфигурации представляют собой так называемую сверхвторичную структуру белка.
Ансамбли сверхвторичной структуры являются основой для формирования в молекулах белков доменов. Это структурно и функционально обособленные области, соединенные друг с другом короткими фрагментами полипептидной цепи — шарнирными участками.
Например, молекулы мембранных белков-рецепторов чаще всего состоят из трех доменов. Надмембранный домен обеспечивает прием внешних сигналов, внутримембранный закрепляет белок в мембране, подмембранный осуществляет передачу сигнала внутрь клетки. Другим примером может служить сывороточный альбумин — белок плазмы крови, способный связываться с высшими карбоновыми кислотами, билирубином, некоторыми токсинами и другими соединениями и доставлять их в те или иные органы. Молекула этого белка содержит три домена, каждый из которых отвечает за избирательное связывание с определенными веществами.*
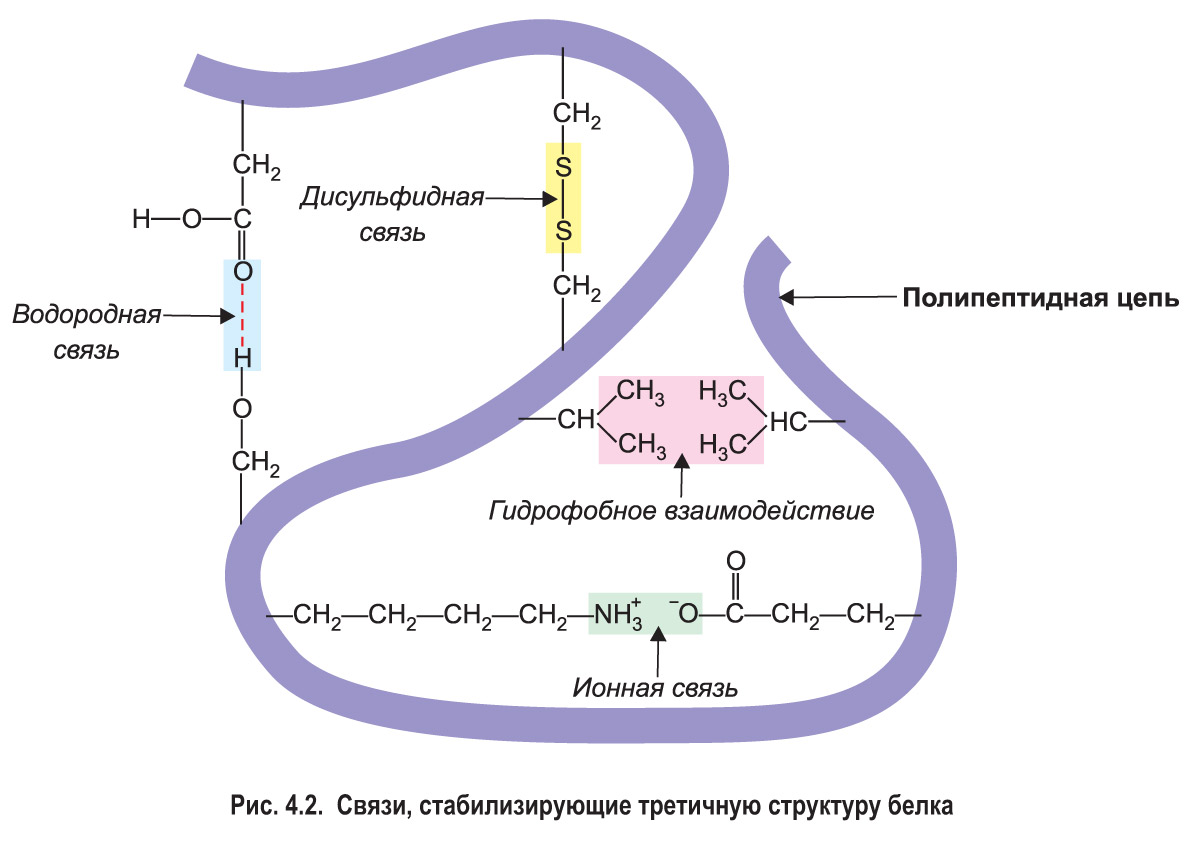
Формирование третичной структуры обеспечивают водородные, ионные и другие связи, возникающие между разными группами атомов белковой молекулы. В водной среде молекула белка особым образом укладывается в пространстве, приобретая компактную форму. При этом гидрофобные аминокислотные радикалы погружаются внутрь белковой молекулы и притягиваются друг к другу — такое притяжение называется гидрофобным взаимодействием. Гидрофильные участки полипептида, наоборот, располагаются на поверхности и взаимодействуют с молекулами воды. У многих белков в образовании третичной структуры участвуют ковалентные дисульфидные связи (S—S связи), которые возникают между остатками аминокислоты цистеина (рис. 4.2). Третичная структура каждого белка имеет особую, неповторимую пространственную конфигурацию.
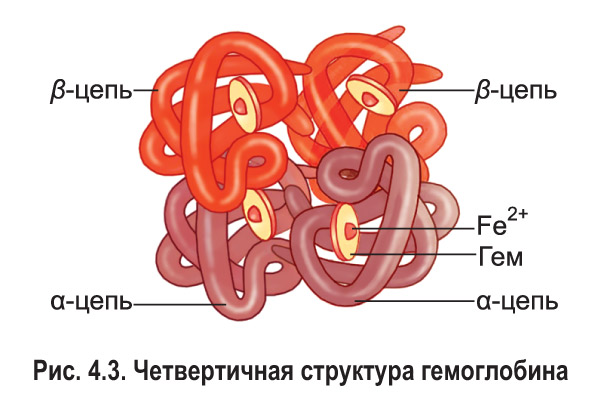
Многие белки способны выполнять свои биологические функции, обладая третичной структурой. Но некоторым белкам для этого необходимо объединение в единый комплекс двух или более молекул, имеющих третичную структуру. Так возникает четвертичная структура белка. Молекулы, входящие в ее состав *(их называют субъединицами или протомерами)*, могут быть одинаковыми или разными. Они удерживаются вместе благодаря различным видам нековалентных связей — водородным, ионным, гидрофобным взаимодействиям и др. В некоторых белках, например иммуноглобулинах, к множеству таких связей добавляются несколько ковалентных дисульфидных. Примером белка, имеющего четвертичную структуру, может служить гемоглобин (рис. 4.3).
В состав гемоглобина человека входят четыре полипептидные цепи двух разных типов: две α-цепи (содержащие по 141 аминокислотному остатку) и две β-цепи (по 146 остатков). Каждая цепь формирует специальный гидрофобный карман, в котором располагается компонент небелковой природы — гем. Центральную часть гема занимает ион Fe2+.
Многообразие и свойства белков. В зависимости от состава различают простые и сложные белки. Молекулы простых белков построены только из аминокислотных остатков *(кератин, коллаген, фибрин, альбумины крови и др.)*. В состав сложных белков, кроме того, входит какой-либо компонент неаминокислотной природы *— так называемая простетическая группа. Более подробная информация о сложных белках приведена в таблице 4.1.*
*Таблица 4.1. Основные группы сложных белков
|
Название |
Простетическая группа |
Примеры |
|
Металлопротеины |
Ион металла |
ДНК-полимераза (содержит Mg2+), |
|
Фосфопротеины |
Фосфорная кислота |
Казеин молока, вителлин яичного желтка |
|
Гликопротеины |
Углевод |
Антитела (иммуноглобулины), муцин слюны |
|
Липопротеины |
Липид |
Тромбопластин, липопротеины клеточных мембран |
|
Нуклеопротеины |
Нуклеиновая кислота |
Хроматин |
|
Хромопротеины |
Окрашенный небелковый компонент (пигмент) |
Гемоглобин, миоглобин* |
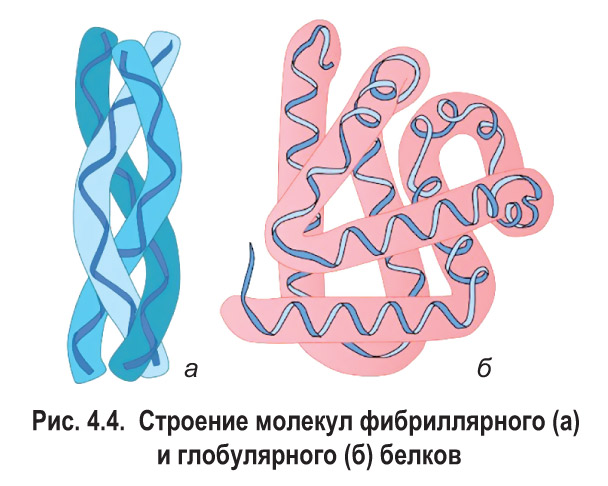 По форме молекул выделяют две группы белков — фибриллярные и глобулярные. Фибриллярными называют белки, молекулы которых имеют вытянутую, нитевидную форму (рис. 4.4). Это, например, коллаген, кератин, миозин. Молекулы глобулярных белков имеют округлую форму. К этой группе относятся альбумины и глобулины крови, гемоглобин и др.
По форме молекул выделяют две группы белков — фибриллярные и глобулярные. Фибриллярными называют белки, молекулы которых имеют вытянутую, нитевидную форму (рис. 4.4). Это, например, коллаген, кератин, миозин. Молекулы глобулярных белков имеют округлую форму. К этой группе относятся альбумины и глобулины крови, гемоглобин и др.
Многие белки хорошо растворяются в воде, однако среди них есть и нерастворимые — кератин, фибрин и др. Известно, что глобулярные белки в основном являются водорастворимыми, а фибриллярные, как правило, в воде не растворяются.
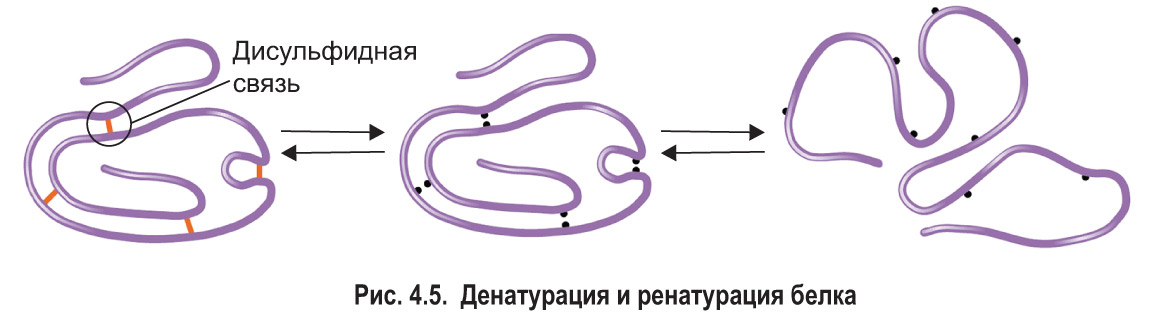
Белки чувствительны к внешним воздействиям: изменение химического состава среды, температуры и других факторов вызывает изменение их структуры и свойств. Действие высоких и низких температур, сильных кислот и щелочей, ионов тяжелых металлов, ультрафиолетового излучения, радиации ведет к разрушению связей, стабилизирующих пространственную конфигурацию белков. Вследствие разрыва водородных, ионных, дисульфидных и других связей белок может последовательно утратить свою четвертичную, третичную и даже вторичную структуру. Процесс нарушения природной структуры белка под влиянием внешних факторов без разрушения его первичной структуры называется денатурацией (рис. 4.5).
Пространственная структура белка определяет его физико-химические свойства и биологические функции. Поэтому денатурация приводит не только к изменению размеров и формы молекул белка, но и его свойств, например растворимости. Неполярные гидрофобные группы, которые располагались внутри молекулы, оказываются на ее поверхности, и белок становится менее гидрофильным. Важно то, что в результате денатурации белки теряют способность выполнять свои функции.
Степень денатурации белка зависит от силы воздействия на него различных факторов: чем интенсивнее их действие, тем глубже денатурация. В ряде случаев она становится необратимой. Однако если фактор, вызвавший денатурацию, действовал непродолжительно, то после прекращения его воздействия белок может восстановить свою природную структуру, свойства и функции. Такое явление называется ренатурацией. Развернутая полипептидная цепь способна самопроизвольно восстановить вторичную структуру, а затем уложиться в третичную. Это означает, что пространственная конфигурация белка определяется его первичной структурой, т. е. последовательностью аминокислотных остатков. Если же воздействие на белок было слишком жестким и привело к разрыву пептидных связей, возвращение белковой молекулы к исходной структуре становится невозможным.
*Большинство белков денатурирует при нагревании выше 50—60 °С. Но, например, денатурация сократительных белков мышц начинается уже при 45—50 °С, а яичный белок денатурирует при температуре 60—70 °С. Белки некоторых термофильных бактерий, обитающих в горячих источниках, могут полноценно функционировать при температурах выше 90 °С!
Явление денатурации широко используется в медицине, биохимических исследованиях, пищевой промышленности и других сферах деятельности человека.
Применение таких антисептиков, как спирт, хлорамин, формалин и т. п., основано на том, что они вызывают денатурацию белков и, вследствие этого, гибель микроорганизмов. То же самое происходит под действием высоких температур при стерилизации медицинских инструментов и материалов. Ультрафиолетовое излучение используется в качестве денатурирующего агента для дезинфекции помещений, промышленного обеззараживания воды и т. д.
Денатурацию белков может вызвать и присоединение к ним ионов тяжелых металлов. При этом они прочно связываются с выпадающим в осадок денатурированным белком. Поэтому при пищевом отравлении соединениями ртути, свинца, меди пострадавшему как можно быстрее дают выпить молоко или раствор яичного белка для того, чтобы ограничить дальнейшее всасывание токсичных веществ.
Осаждение белков при денатурации также применяется в лабораторной практике. Оно позволяет удалять белки из различных жидкостей биологического происхождения (например, плазмы крови, ликвора), что облегчает процессы выделения и анализа других веществ, входящих в состав таких жидкостей. Кроме того, осаждение белков используется для определения их количественного содержания в биологическом материале.
Денатурация находит применение в пищевой промышленности, например, для получения творога, желатина и др. Тепловая обработка продуктов питания используется не только для уничтожения содержащихся в них микроорганизмов. Белки, входящие в состав пищевых продуктов, денатурируют, вследствие чего они легче расщепляются пищеварительными ферментами и лучше усваиваются организмом.*
*Радикалы ряда аминокислот, входящих в состав белковой молекулы, содержат оснóвные и кислотные функциональные группы. Поэтому белки, как и аминокислоты, являются амфотерными соединениями. Амфотерность придает белкам буферные свойства.
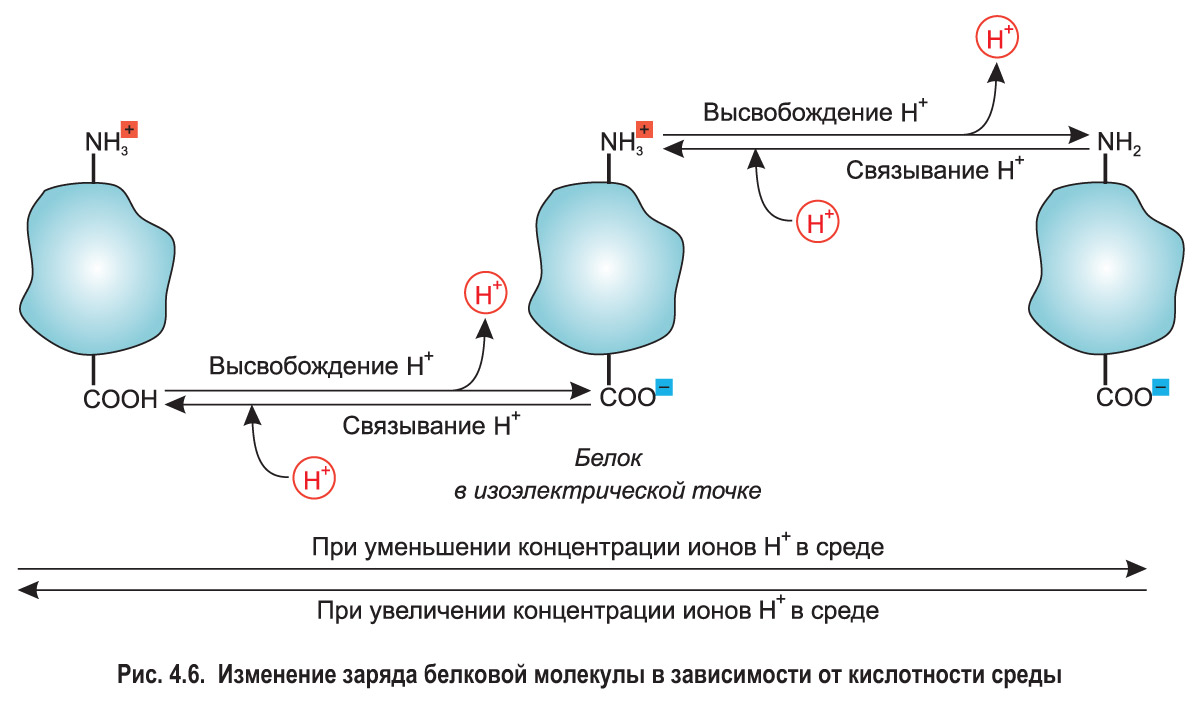
Так, при повышении кислотности (т. е. при увеличении концентрации ионов водорода) подавляется диссоциация карбоксильных групп, содержащихся в радикалах кислых аминокислот. В то же время аминогруппы оснóвных аминокислот связывают избыток ионов H+. За счет этого при определенной величине pH молекула белка приобретает положительный заряд (рис. 4.6).
Снижение кислотности среды усиливает диссоциацию групп —СООН. При этом высвобождаются дополнительные ионы водорода и заряд белковой молекулы становится отрицательным. Таким образом, белки способны в определенной степени поддерживать уровень рН среды. Например, альбумины и глобулины участвуют в поддержании слабощелочной реакции плазмы крови (совместно с другими буферными системами).*
*При определенном значении pH количество положительно и отрицательно заряженных групп в молекуле белка становится одинаковым, и его суммарный электрический заряд оказывается равным нулю. Такое значение pH называют изоэлектрической точкой белка (см. рис. 4.6). Каждый белок имеет определенное значение изоэлектрической точки, которое определяется аминокислотным составом. Изоэлектрические точки белков, в составе которых преобладают остатки кислых аминокислот, располагаются в области pH < 7, а белков, в которых преобладают оснóвные аминокислоты, — в диапазоне pH > 7.
У большинства белков значение изоэлектрической точки находится в пределах 5,5—7,0. Но, например, для пепсина (фермента желудочного сока) величина изоэлектрической точки равна 1, а для сальмина (белка, содержащегося в молóках семги) — почти 12.
Чем больше значение рН среды отличается от изоэлектрической точки, тем больший заряд имеет белок. Из-за этого между белковыми молекулами существует электростатическое отталкивание, препятствующее их слипанию (агрегации). В изоэлектрической точке силы отталкивания минимальны. Из-за этого белки наименее устойчивы в растворе, их молекулы легко слипаются и выпадают в осадок.*

Белки — биополимеры, образованные остатками аминокислот. Аминокислоты, соединяясь пептидными связями, образуют полипептидную цепь — первичную структуру белка. На ее основе формируются более сложные пространственные структуры — вторичная, третичная, четвертичная. По составу различают простые и сложные белки, в зависимости от формы молекул — фибриллярные и глобулярные. Под воздействием ряда факторов белки могут денатурировать — утрачивать свою природную структуру, что ведет к потере биологической активности. Белки обладают буферными свойствами.
 |
1. Охарактеризуйте уровни структурной организации белков. Какие химические связи обусловливают существование и стабильность первичной, вторичной, третичной и четвертичной структур белков? 2. Чем простые белки отличаются от сложных? Фибриллярные от глобулярных? Приведите примеры фибриллярных и глобулярных белков. 3. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул? 4. За счет чего белки обладают буферными свойствами? Каким образом они участвуют в поддержании определенной кислотности среды? 5*. Докажите, что пространственная структура белка определяет его физико-химические свойства и биологические функции. 6*. Для разделения смеси белков на компоненты используется метод электрофореза: в геле определенной плотности под действием электрического поля различные белковые молекулы перемещаются с разными скоростями. В результате этого одинаковые молекулы концентрируются в определенном участке геля. Как вы думаете, почему так происходит? |

Наблюдение денатурации белка
Вспомните, как тепловая обработка влияет на цвет яичного белка и его растворимость в воде. Очевидно, что свойства белка изменяются вследствие его денатурации под действием высокой температуры.
Налейте в стакан немного молока и добавьте в него 1—2 мл уксуса (лимонного сока или раствора лимонной кислоты).
● Что вы наблюдаете?
● Как изменилась растворимость казеина — основного молочного белка?
● Как вы думаете, что произошло с молекулами казеина?
● Подобное явление происходит и при обычном скисании молока. Вспомните, под воздействием каких микроорганизмов происходит этот процесс. Какое вещество является денатурирующим агентом?