§ 33. Водородные соединения кислорода и серы
Вода
Вода — второе по распространённости на Земле химическое соединение. Запасы воды на Земле оцениваются в 1,4 млрд км3. Она составляет от 50 до 99 % массы растений, животных, человека.
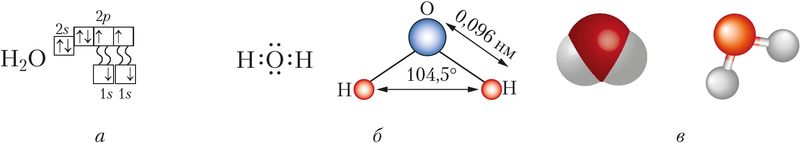
Строение молекулы. Молекула воды имеет угловое строение, которое определяют четыре электронные орбитали внешнего электронного слоя атома кислорода: две из них образуют ковалентные полярные связи с атомами водорода, другие две содержат неподелённые электронные пары (рис. 77). Как вам известно, угол между направлениями связей Н—О в молекуле водяного пара составляет 104,5° и молекулы представляют собой диполи (§ 14, рис. 33).
Особенности физических свойств. Вода не имеет цвета, вкуса, запаха, обладает высокой теплоёмкостью. Вода существует в природе в трёх агрегатных состояниях (жидком, твёрдом, газообразном). Её температура плавления — 0 °С, кипения — 100 °С при p = 101,325 кПа. Между молекулами воды в жидком и твёрдом состояниях существуют прочные водородные связи (25 кДж/моль) (§ 17, рис. 43).
Вода, являясь очень слабым электролитом, практически не проводит электрический ток. На ионы распадаются приблизительно две молекулы из миллиарда (при 25 °С): «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mi mathvariant=¨normal¨»§#1053;«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»§#1054;«/mi»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»§#1053;«/mi»«mo»+«/mo»«/msup»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msup»«mi»§#1054;§#1053;«/mi»«mo»§#8211;«/mo»«/msup»«/math».
Химические свойства воды. Вода вступает в реакции со многими веществами как при комнатной температуре, так и при нагревании: металлами, основными и кислотными оксидами, органическими веществами. Рассмотрим некоторые особенности этих взаимодействий.
1. Характер взаимодействия воды с металлами зависит от активности металла. Так, щелочные и щёлочноземельные (Са, Ва, Sr, Ra) металлы реагируют при комнатной температуре с образованием водорода и щёлочи:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle indentalign=¨center¨»«mn»2«/mn»«mi»Na«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mi»NaOH«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»H«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo stretchy=¨false¨»§#8593;«/mo»«mo»;«/mo»«mspace linebreak=¨newline¨/»«mi»§#1057;§#1072;«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mover»«mi mathvariant=¨normal¨»H«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»§#1054;«/mi»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«mi»§#1057;§#1072;«/mi»«msub»«mrow»«mo»(«/mo»«mi»§#1054;§#1053;«/mi»«mo»)«/mo»«/mrow»«mn»2«/mn»«/msub»«mo stretchy=¨false¨»§#8595;«/mo»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»H«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo stretchy=¨false¨»§#8593;«/mo»«mo».«/mo»«/mstyle»«/math»
Большинство металлов, расположенных в ряду активности между алюминием и водородом, вступают в реакцию с парами воды с образованием водорода и оксидов металлов. Металлы, расположенные после водорода, ни при каких условиях с водой не реагируют. Более детально вы изучите реакции взаимодействия металлов с водой в главе 7.
2. Взаимодействие воды с кислотными оксидами приводит к образованию кислот:
SO3 + H2O = H2SO4.
3. Основные оксиды щелочных и щёлочноземельных металлов в реакциях с водой образуют щёлочи:
СаО + Н2О = Са(ОН)2↓.
4. С органическими веществами вода вступает в реакции гидратации (ненасыщенных соединений) и гидролиза (сложных эфиров, углеводов, белков). Например:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle indentalign=¨center¨»«msub»«mi»§#1057;§#1053;«/mi»«mn»2«/mn»«/msub»«mo»=«/mo»«msub»«mi»§#1057;§#1053;«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mover»«mo stretchy=¨false¨»§#8594;«/mo»«mrow»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»3«/mn»«/msub»«msub»«mi»PO«/mi»«mn»4«/mn»«/msub»«mo»,«/mo»«mo mathvariant=¨italic¨»§#160;«/mo»«mi»t«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»p«/mi»«/mrow»«/mover»«mo»§#160;«/mo»«msub»«mi»§#1057;§#1053;«/mi»«mn»3«/mn»«/msub»«msub»«mi»§#1057;§#1053;«/mi»«mn»2«/mn»«/msub»«mi»§#1054;§#1053;«/mi»«mo»;«/mo»«mspace linebreak=¨newline¨/»«msub»«mi»§#1057;§#1053;«/mi»«mn»3«/mn»«/msub»«msub»«mi»§#1057;§#1054;§#1054;§#1057;«/mi»«mn»2«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»§#1053;«/mi»«mn»5«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»§#1053;«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»§#1054;«/mi»«mover»«mrow»«mo»§#160;«/mo»«mo stretchy=¨false¨»§#8644;«/mo»«mo»§#160;«/mo»«/mrow»«mrow»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»,«/mo»«mo mathvariant=¨italic¨»§#160;«/mo»«mi»t«/mi»«/mrow»«/mover»«msub»«mi»§#1057;§#1053;«/mi»«mn»3«/mn»«/msub»«mi»§#1057;§#1054;§#1054;§#1053;«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»§#1057;«/mi»«mn»2«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»§#1053;«/mi»«mn»5«/mn»«/msub»«mi»§#1054;§#1053;«/mi»«mo».«/mo»«/mstyle»«/math»
Гидролиз белков, ди- и полисахаридов, жиров — это первый этап усвоения (переваривания) пищи.
5. Вода вступает в реакции с галогенами. Фтор окисляет кислород в молекуле воды:
2H2O + 2F2 = 4HF + O2↑.
Реакции с хлором и бромом протекают обратимо с образованием двух кислот, в одной из которых степень окисления атома галогена повышена, а в другой понижена:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msub»«mover»«mi»§#1057;l«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mstyle indentalign=¨center¨»«mpadded lspace=¨-11px¨»«munder»«mrow»«mo»§#8644;«/mo»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi»Cl«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mi mathvariant=¨normal¨»O«/mi»«/mrow»«mpadded lspace=¨-15px¨ voffset=¨+2px¨»«mi»§#1093;§#1083;§#1086;§#1088;§#1085;§#1086;§#1074;§#1072;§#1090;§#1080;§#1089;§#1090;§#1072;§#1103;«/mi»«mspace linebreak=¨newline¨/»«mi»§#1082;§#1080;§#1089;§#1083;§#1086;§#1090;§#1072;«/mi»«/mpadded»«/munder»«mpadded lspace=¨-38px¨»«munder»«mrow»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi»Cl«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»;«/mo»«/mrow»«mpadded lspace=¨+28px¨ voffset=¨+1px¨»«mi»§#1093;§#1083;§#1086;§#1088;§#1086;§#1074;§#1086;§#1076;§#1086;§#1088;§#1086;§#1076;§#1085;§#1072;§#1103;«/mi»«mspace linebreak=¨newline¨/»«mi»§#1082;§#1080;§#1089;§#1083;§#1086;§#1090;§#1072;«/mi»«/mpadded»«/munder»«/mpadded»«/mpadded»«/mstyle»«/math»
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mover»«mrow»«mover»«mi mathvariant=¨normal¨»B«/mi»«mn»0«/mn»«/mover»«msub»«mi mathvariant=¨normal¨»r«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mrow/»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»O«/mi»«mpadded lspace=¨-12px¨»«munder»«mrow»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi»Br«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mi mathvariant=¨normal¨»O«/mi»«/mrow»«mstyle indentalign=¨center¨»«mpadded voffset=¨+3px¨»«mi»§#1073;§#1088;§#1086;§#1084;§#1085;§#1086;§#1074;§#1072;§#1090;§#1080;§#1089;§#1090;§#1072;§#1103;«/mi»«mspace linebreak=¨newline¨/»«mi»§#1082;§#1080;§#1089;§#1083;§#1086;§#1090;§#1072;«/mi»«/mpadded»«/mstyle»«/munder»«mpadded lspace=¨-8px¨»«mo»+«/mo»«mo»§#160;«/mo»«munder»«mpadded lspace=¨-33px¨»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi»Br«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo».«/mo»«/mpadded»«mpadded voffset=¨+2px¨»«mtable columnspacing=¨0px¨ columnalign=¨right center left¨»«mtr»«mtd/»«mtd/»«mtd»«mi»§#1073;§#1088;§#1086;§#1084;§#1086;§#1074;§#1086;§#1076;§#1086;§#1088;§#1086;§#1076;§#1085;§#1072;§#1103;«/mi»«/mtd»«/mtr»«mtr»«mtd/»«mtd/»«mtd»«mi»§#1082;§#1080;§#1089;§#1083;§#1086;§#1090;§#1072;«/mi»«/mtd»«/mtr»«/mtable»«/mpadded»«/munder»«/mpadded»«/mpadded»«/math»
6. С ионными гидридами металлов вода выступает в качестве окислителя:
NaH + H2O = NaOH + H2↑.
7. Соли слабых кислот и соли неактивных металлов, а также соли аммония в водной среде подвергаются гидролизу (см. § 27.1.):
СН3СОО– + НОН «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mo»§#8644;«/mo»«/math» СН3СООН + ОН–;
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msup»«msup»«mi»§#1057;u«/mi»«mrow»«mn»2«/mn»«mo»+«/mo»«/mrow»«/msup»«mrow/»«/msup»«mo»+«/mo»«mo»§#160;«/mo»«mi»HOH«/mi»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«msup»«mi»CuOH«/mi»«mo»+«/mo»«/msup»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»;«/mo»«/math»
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«msubsup»«mi»NH«/mi»«mn»4«/mn»«mo»+«/mo»«/msubsup»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»HOH«/mi»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«msub»«mi»NH«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«mi mathvariant=¨bold¨»§#903;«/mi»«mo mathvariant=¨bold¨»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mi mathvariant=¨normal¨»O«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«/math».