§ 45.1. Атрыманне металаў электролізам водных раствораў солей
Прыклады выкарыстання электролізу водных раствораў солей металаў у прамысловасці і ў лабараторыі
Пры распрацоўцы ўмоў электролізу варта ўлічваць, што прадукты электролізу могуць уступаць у хімічныя рэакцыі з электродамі і воднымі растворамі або паміж сабой.
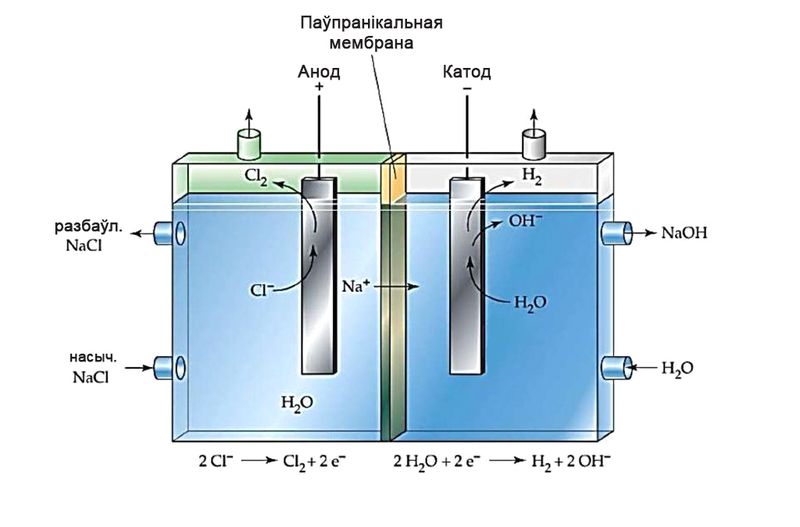
Прамысловы электроліз воднага раствору NaCl. Працэс выкарыстоўваюць для атрымання вадароду, хлору і каўстычнай соды (NaOH). Пры гэтым на катодзе вылучаецца вадарод:
2Н2О + 2е– = Н2↑ + 2ОН–,
на анодзе — хлор:
2Cl– – 2e– = Cl2↑,
а ў растворы назапашваецца каўстычная сода:
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑.
Калі не падзяліць прадукты электролізу, то паміж утворанымі газамі адбудзецца хімічная рэакцыя.
У растворы таксама магчымае ўзаемадзеянне хлору са шчолаччу:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для таго каб паміж прадуктамі электролізу не адбывалася ўзаемадзеянне, катодную і анодную прасторы падзяляюць мембранай (мал. 108.2).
З 2015 года ў ААТ «Беларуськалій» функцыянуе цэх мембраннага электролізу. Прадукцыяй цэха з’яўляюцца: водны раствор гідраксіду калію (з масавай доляй KOH 46–54 %); цвёрды гідраксід калію (з масавай доляй KOH 90–95 %); саляная кіслата (з масавай доляй HCl 28–35 %); гіпахларыт натрыю NaClO.
Электроліз раствораў солей у лабараторыі.
Для нагляднасці пры разглядзе асаблівасцей электролізу водных раствораў солей звернемся да хімічнага эксперыменту.
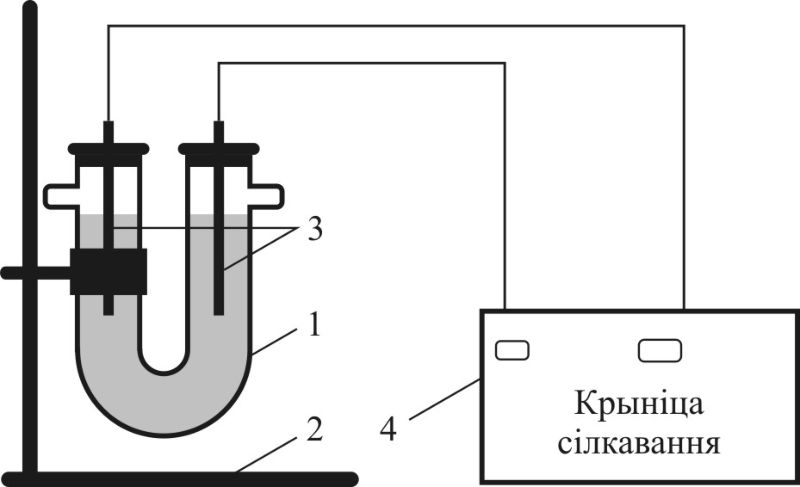
1 — U-падобная трубка (электралізёр);
2 — штатыў;
3 — электроды (графітавыя стрыжні);
4 — крыніца сілкавання пастаяннага току
Дослед 1. Правядзем электроліз воднага раствору CuSO4. Для гэтага збярэм прыбор па схеме, паказанай на мал. 108.3. У U-падобную трубку нальем раствор сульфату медзі(II) і апусцім два графітавыя стрыжні, замацаваныя ў гумавых корках. Стрыжні з дапамогай правадоў далучым да крыніцы току, на якой падтрымліваецца напружанне пастаяннага току да 12 В.

Пры прапусканні электрычнага току праз раствор CuSO4 на стрыжні, далучаным да дадатнага полюса крыніцы току (анод), можна назіраць вылучэнне бурбалак газу (гэта кісларод), а на стрыжні, далучаным да адмоўнага полюса (катод), — з’яўленне чырвонага налёту (гэта адноўленая медзь) (мал. 108.4).
Растлумачыць назіраную з’яву можна наступнымі працэсамі.
У растворы сульфату медзі адбываецца дысацыяцыя:
CuSO4 → Cu2+ + .
Пры падключэнні электродаў да крыніцы току ў растворы электраліту адбываецца накіраваны рух іонаў да электродаў, якія маюць супрацьлеглыя зарады.
На катодзе адбываецца аднаўленне медзі, якая ўтварае чырвоны налёт на электродзе:
Сu2+ + 2e– = Сu0
На анодзе (дадатна зараджаным электродзе) адбываецца акісленне малекул вады з вылучэннем кіслароду:
2Н2О – 4e– = О2↑ + 4Н+.
Сумарнае ўраўненне працэсаў на электродах у малекулярнай форме:
2СuSO4 + 2Н2О 2Сu0 + О2↑ + 2Н2SO4.
Дослед 2. Правядзіце электроліз воднага раствору ёдыду калію.
Для правядзення электролізу раствору KI скарыстаем устаноўку з прыкладу 1 (мал. 108.3).
У U-падобную трубку нальем раствор KI і прапусцім праз яго электрычны ток. Праз 3-5 хвілін, адключыўшы ток і дастаўшы электроды, у катодную прастору дададзім 2-3 кроплі фенолфталеіну, а ў анодную прастору дабавім крухмальны клейстар.

Раствор у катоднай прасторы афарбоўваецца ў малінавы колер, што сведчыць пра шчолачнае асяроддзе. У аноднай прасторы назіраецца вылучэнне жоўта-бурага рэчыва, пры дадаванні да якога 2-3 кропель крухмальнага клейстару адбываецца пасіненне раствору, што паказвае на прысутнасць у растворы ёду (мал. 108.5).
Такім чынам, прадуктамі электролізу воднага раствору ёдыду калію з’яўляюцца I2 і шчолач.
Назіраныя з’явы сведчаць аб працяканні на электродах наступных рэакцый:
2Н2О + 2e– = Н2↑ + 2ОН– на катодзе;
2I– – 2e– = I2 на анодзе.
Сумарнае ўраўненне працэсу электролізу ў малекулярнай форме:
2Н2О + 2KI Н2↑ + I2 + 2KОН.
Электроліз з актыўнымі анодамі ў прамысловасці. Акрамя электрахімічнага асаджвання металічных пакрыццяў і атрымання парашкоў металаў, гэты метад ужываюць для здабывання металаў з раствораў, а таксама для ачысткі (рафінавання) металаў ад утрыманых у іх прымесей. Так атрымліваюць чыстае золата, медзь і многія іншыя металы.
Напрыклад, пры ачыстцы (рафінаванні) медзі зыходны метал, які ўтрымлівае непажаданыя прымесі, служыць анодам. Анод апускаюць у раствор сульфату медзі(II). Пры прапусканні току медзь на анодзе акісляецца, яе іоны пераходзяць у раствор, перамяшчаюцца да катода і на ім аднаўляюцца. Прымесі ў гэтым працэсе не ўдзельнічаюць з-за іх малой канцэнтрацыі, і таму на катодзе ўтвараецца слой чыстай медзі.
Працэсы электролізу з актыўнымі анодамі выкарыстоўваюць для атрымання пакрыццяў з аксідаў металаў. Так, пры правядзенні электролізу з анодам з алюмінію яго паверхня акісляецца, пакрываючыся слоем аксіду. Такі працэс спецыяльнага нарошчвання аксіду на паверхні металу называюць электрахімічным аксідзіраваннем (або анадзіраваннем). Анадзіраванне ўжываюць для абароны металу ад карозіі, надання яго паверхні дэкаратыўнага знешняга выгляду, павышанай цвёрдасці.
Метадам электролізу раствораў солей на паверхню розных вырабаў наносяць пакрыцці з металаў і іх сплаваў, кампазітаў з неметаламі, што надае вырабам патрэбныя ўласцівасці (павышаная каразійная ўстойлівасць, дэкаратыўнае аздабленне, электраправоднасць і інш.). Да распаўсюджаных прамысловых працэсаў адносяцца цынкаванне, нікеляванне, алавяненне, мядненне, храмаванне, залачэнне і серабрэнне.
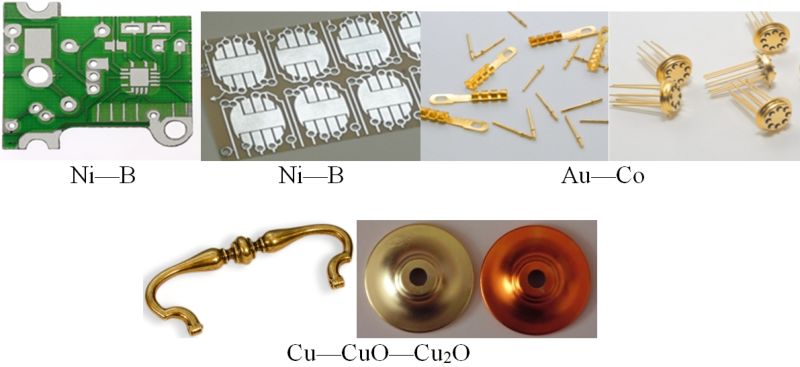
У НДІ фізіка-хімічных праблем Беларускага дзяржаўнага ўніверсітэта распрацаваны і ўкаранёны ў прамысловасць працэсы электрахімічнага асаджвання пакрыццяў са сплаваў металаў і кампазіцыйных пакрыццяў метал — аксід металу, напрыклад: Ni—B, Ni—P, Ni—Sn, Au—Co, Сu—CuO—Cu2O, Ni — алмаз (алмаз у выглядзе тонка здробненага парашку). Такія пакрыцці больш цвёрдыя, зноса- і каразійнаўстойлівыя, чым пакрыцці з індывідуальных металаў, маюць дэкаратыўны знешні выгляд (мал. 108.6).
Электроліз водных раствораў выкарыстоўваецца таксама ў сінтэзе розных неарганічных рэчываў, у апрацоўцы паверхняў металаў (азатаванне, барыраванне, электрапаліроўка, ачыстка), у ачыстцы сцёкавых вод (працэсы электракаагуляцыі, электраэкстракцыі, электрафлатацыі). Электролізам атрымліваюць кісларод і вадарод.