§ 45.1. Атрыманне металаў электролізам водных раствораў солей
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 45.1. Атрыманне металаў электролізам водных раствораў солей |
| Напечатано:: | Гость |
| Дата: | Saturday, 22 November 2025, 15:39 |
У § 45 вы пазнаёміліся з электрахімічным метадам прамысловага атрымання металаў, які заснаваны на электролізе, — электраметалургіяй.
У гэтага метаду ёсць дзве разнавіднасці. Першая — гэта правядзенне электролізу расплаву злучэнняў металаў. Асаблівасці гэтага спосабу вы разгледзелі на прыкладзе электролізу расплаву хларыду магнію.
Другая разнавіднасць электрахімічнага метаду, званая гідраэлектраметалургіяй, заснавана на электролізе водных раствораў солей металаў. Перавага гэтага метаду, у параўнанні з электролізам расплаваў, заключаецца ў тым, што ён не патрабуе энергетычных выдаткаў на расплаўленне рэчыва. Абмежаванне электралітычнага метаду здабывання металаў з водных раствораў у тым, што ён прыдатны толькі для металаў, якія стаяць у радзе актыўнасці металаў правей за алюміній.
Асаблівасць правядзення электролізу водных раствораў солей заключаецца ў тым, што разам з працэсамі аднаўлення іонаў металу на катодзе і акіслення аніёнаў солі на анодзе працякае канкурэнтны працэс электролізу малекул вады. У выніку на катодзе можа вылучацца вадарод, а на анодзе — кісларод.
|
Працэсы на катодзе: 2Н+ + 2е– = Н2↑ пры рН < 7; 2Н2О + 2е– = Н2↑ + 2ОН– ≥ 7. |
Працэсы на анодзе: 2Н2О – 4е– = О2↑ + 4Н+ пры рН ≤ 7; 4ОН– – 4е– = О2↑ + 2Н2О пры рН > 7. |
Працэсы на катодзе
Здольнасць металаў аднаўляцца на катодзе пры электролізе воднага раствору солей вызначаецца становішчам металу ў радзе актыўнасці.
Катыёны металаў у левай частцы раду актыўнасці, заканчываючы алюмініем (Li+, Na+, K+, ... Аl3+), пры электролізе не аднаўляюцца. Замест іх аднаўляецца вадарод з малекул вады:
2Н2О + 2е– = Н2↑ + 2ОН–.
Катыёны металаў, размешчаных у радзе актыўнасці правей за вадарод (Cu2+, Ag+, Hg2+, Pt2+, Au3+), пры электролізе аднаўляюцца на катодзе да металу:
Cu2+ + 2е– = Cu0;
Au3+ + 3е– = Au0.
Гэты працэс дамінуе, але калі электраліт мае моцна кіслае асяроддзе, то адначасова з іонамі металу могуць аднаўляцца іоны вадароду:
2H+ + 2е– = Н2↑.
Катыёны металаў, размешчаных у радзе актыўнасці паміж алюмініем і вадародам (Mn2+, Zn2+, Сr3+, Fe2+, ... Pb), пры электролізе аднаўляюцца на катодзе адначасова з вадародам з вады:
Ni2+ + 2e– = Ni0;
2Н2О + 2е– = Н2↑ + 2ОН–.
Пры электролізе водных раствораў солей металаў варта ўлічваць магчымасць працякання працэсаў гідролізу, які паскараецца ў выніку ўтварэння гідраксід-іонаў у электраліце паблізу катода. У выніку на паверхні катода могуць утварацца нерастваральныя асноўныя солі і асновы:
2Cu2+ + + 2ОН– → (CuOH)2SO4;
Ni2+ + 2OH– → Ni(OH)2.
Электраправоднасць электрода памяншаецца, і працэс электролізу запавольваецца або спыняецца. Адзін са спосабаў барацьбы з такой з’явай — падкісленне электралітаў.
Працэсы на анодзе
На анодзе працякаюць працэсы акіслення кампанентаў электраліту. У працэсе акіслення можа ўдзельнічаць і матэрыял самага анода. Адрозніваюць працэсы электролізу ў растворах з актыўным і інертным анодамі.
Інертныя аноды не акісляюцца пад дзеяннем электрычнага току і не рэагуюць з рэчывамі раствору. Пры электролізе яны служаць толькі перадатчыкамі электронаў. Інертнымі з’яўляюцца электроды з графіту, плаціны, плацінаванага тытану.
Да актыўных адносяцца аноды, вырабленыя з Сu, Ag, Fe, Ni, Sn, Zn. Метал актыўных анодаў у працэсе электролізу разбураецца і пераходзіць у раствор у выглядзе іонаў. Актыўныя аноды звычайна ўжываюць у прамысловасці пры атрыманні пакрыццяў шляхам электрахімічнага аднаўлення металаў з раствораў, паколькі растварэнне металічнага анода ў працэсе электролізу папаўняе страту іонаў металу, які аднаўляецца, з электраліту. Пры гэтым яны забяспечваюць пастаянства саставу раствору, хуткасці працэсу электролізу, саставу і ўласцівасцей атрыманых металічных пакрыццяў.
Разгледзім падрабязней працэсы, якія працякаюць пры электролізе раствораў на інертных анодах. Можна вылучыць наступныя заканамернасці (табл. 31.1):
• у растворах бескіслародных кіслот і іх солей (акрамя HF і фтарыдаў) на анодзе акісляюцца аніёны, напрыклад:
2Cl– – 2e– = Cl2↑;
• у растворах кіслародзмяшчальных кіслот і іх солей у выпадку максімальнай ступені акіслення атамаў неметалу ў аніёне (,
) акісляюцца атамы кіслароду ў малекулах вады з вылучэннем газападобнага кіслароду:
2Н2О – 4е– = О2↑ + 4Н+;
• у растворах кіслародзмяшчальных кіслот і іх солей, у аніёнах якіх утрымліваюцца атамы неметалу ў прамежкавай ступені акіслення (,
), акісляюцца менавіта гэтыя атамы ў саставе аніёнаў, напрыклад:
– 2e– + 2OH– =
+ H2O.
Табліца 31.1. Здольнасць да акіслення на анодзе аніёнаў пры электролізе воднага раствору солей
| Аніёны кіслародзмяшчальных кіслот і фтарыд-іон | Аніёны бескіслародных кіслот |
| Cl−, Br−, I−, S2− | |
|
У водным растворы не акісляюцца; акісленню падвяргаюцца малекулы вады з вылучэннем кіслароду: 2Н2О – 4е– = О2↑+ 4Н+ |
У водным растворы лёгка акісляюцца, напрыклад: 2Cl– – 2e– = Cl2↑ |
У спецыяльна створаных умовах у водных растворах можа ісці працэс акіслення і кіслародзмяшчальных аніёнаў з максімальнай ступенню акіслення неметалу. Напрыклад, электролізам канцэнтраванага раствору гідрасульфату калію атрымліваюць моцны акісляльнік — пероксадысульфат калію:
2KHSO4 K2S2O8 + H2↑.
Прыклады выкарыстання электролізу водных раствораў солей металаў у прамысловасці і ў лабараторыі
Пры распрацоўцы ўмоў электролізу варта ўлічваць, што прадукты электролізу могуць уступаць у хімічныя рэакцыі з электродамі і воднымі растворамі або паміж сабой.
Прамысловы электроліз воднага раствору NaCl. Працэс выкарыстоўваюць для атрымання вадароду, хлору і каўстычнай соды (NaOH). Пры гэтым на катодзе вылучаецца вадарод:
2Н2О + 2е– = Н2↑ + 2ОН–,
на анодзе — хлор:
2Cl– – 2e– = Cl2↑,
а ў растворы назапашваецца каўстычная сода:
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑.
Калі не падзяліць прадукты электролізу, то паміж утворанымі газамі адбудзецца хімічная рэакцыя.
У растворы таксама магчымае ўзаемадзеянне хлору са шчолаччу:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для таго каб паміж прадуктамі электролізу не адбывалася ўзаемадзеянне, катодную і анодную прасторы падзяляюць мембранай (мал. 108.2).
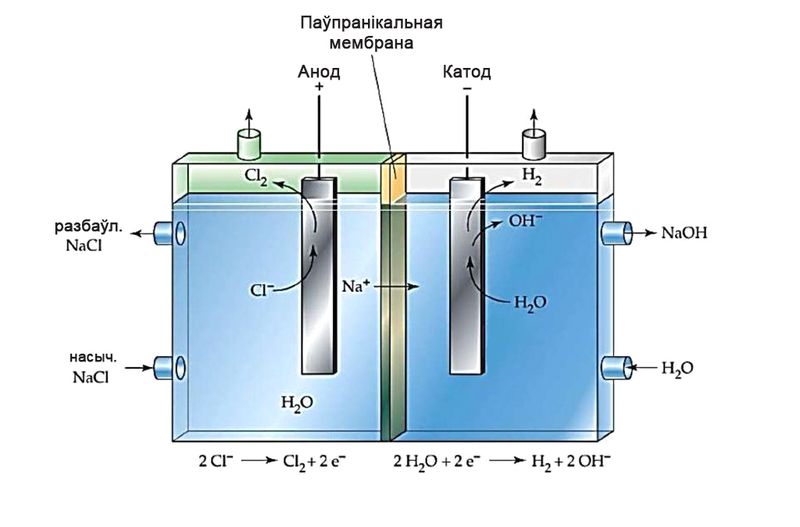
З 2015 года ў ААТ «Беларуськалій» функцыянуе цэх мембраннага электролізу. Прадукцыяй цэха з’яўляюцца: водны раствор гідраксіду калію (з масавай доляй KOH 46–54 %); цвёрды гідраксід калію (з масавай доляй KOH 90–95 %); саляная кіслата (з масавай доляй HCl 28–35 %); гіпахларыт натрыю NaClO.
Электроліз раствораў солей у лабараторыі.
Для нагляднасці пры разглядзе асаблівасцей электролізу водных раствораў солей звернемся да хімічнага эксперыменту.
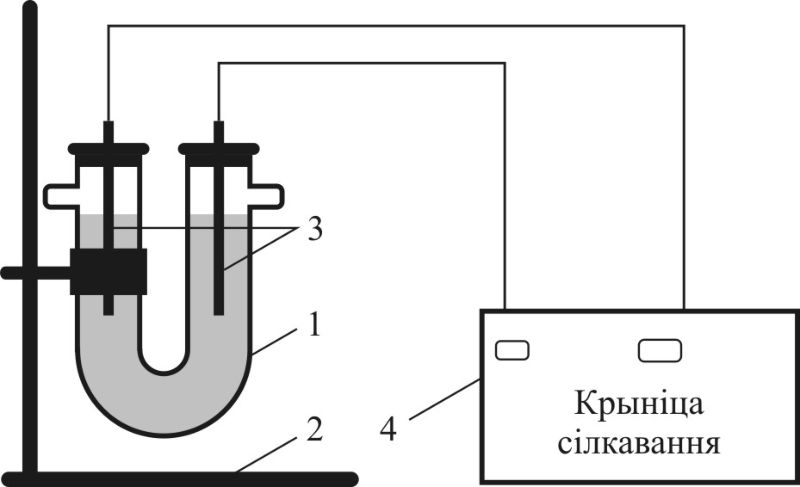
1 — U-падобная трубка (электралізёр);
2 — штатыў;
3 — электроды (графітавыя стрыжні);
4 — крыніца сілкавання пастаяннага току
Дослед 1. Правядзем электроліз воднага раствору CuSO4. Для гэтага збярэм прыбор па схеме, паказанай на мал. 108.3. У U-падобную трубку нальем раствор сульфату медзі(II) і апусцім два графітавыя стрыжні, замацаваныя ў гумавых корках. Стрыжні з дапамогай правадоў далучым да крыніцы току, на якой падтрымліваецца напружанне пастаяннага току да 12 В.

Пры прапусканні электрычнага току праз раствор CuSO4 на стрыжні, далучаным да дадатнага полюса крыніцы току (анод), можна назіраць вылучэнне бурбалак газу (гэта кісларод), а на стрыжні, далучаным да адмоўнага полюса (катод), — з’яўленне чырвонага налёту (гэта адноўленая медзь) (мал. 108.4).
Растлумачыць назіраную з’яву можна наступнымі працэсамі.
У растворы сульфату медзі адбываецца дысацыяцыя:
CuSO4 → Cu2+ + .
Пры падключэнні электродаў да крыніцы току ў растворы электраліту адбываецца накіраваны рух іонаў да электродаў, якія маюць супрацьлеглыя зарады.
На катодзе адбываецца аднаўленне медзі, якая ўтварае чырвоны налёт на электродзе:
Сu2+ + 2e– = Сu0
На анодзе (дадатна зараджаным электродзе) адбываецца акісленне малекул вады з вылучэннем кіслароду:
2Н2О – 4e– = О2↑ + 4Н+.
Сумарнае ўраўненне працэсаў на электродах у малекулярнай форме:
2СuSO4 + 2Н2О 2Сu0 + О2↑ + 2Н2SO4.
Дослед 2. Правядзіце электроліз воднага раствору ёдыду калію.
Для правядзення электролізу раствору KI скарыстаем устаноўку з прыкладу 1 (мал. 108.3).
У U-падобную трубку нальем раствор KI і прапусцім праз яго электрычны ток. Праз 3-5 хвілін, адключыўшы ток і дастаўшы электроды, у катодную прастору дададзім 2-3 кроплі фенолфталеіну, а ў анодную прастору дабавім крухмальны клейстар.

Раствор у катоднай прасторы афарбоўваецца ў малінавы колер, што сведчыць пра шчолачнае асяроддзе. У аноднай прасторы назіраецца вылучэнне жоўта-бурага рэчыва, пры дадаванні да якога 2-3 кропель крухмальнага клейстару адбываецца пасіненне раствору, што паказвае на прысутнасць у растворы ёду (мал. 108.5).
Такім чынам, прадуктамі электролізу воднага раствору ёдыду калію з’яўляюцца I2 і шчолач.
Назіраныя з’явы сведчаць аб працяканні на электродах наступных рэакцый:
2Н2О + 2e– = Н2↑ + 2ОН– на катодзе;
2I– – 2e– = I2 на анодзе.
Сумарнае ўраўненне працэсу электролізу ў малекулярнай форме:
2Н2О + 2KI Н2↑ + I2 + 2KОН.
Электроліз з актыўнымі анодамі ў прамысловасці. Акрамя электрахімічнага асаджвання металічных пакрыццяў і атрымання парашкоў металаў, гэты метад ужываюць для здабывання металаў з раствораў, а таксама для ачысткі (рафінавання) металаў ад утрыманых у іх прымесей. Так атрымліваюць чыстае золата, медзь і многія іншыя металы.
Напрыклад, пры ачыстцы (рафінаванні) медзі зыходны метал, які ўтрымлівае непажаданыя прымесі, служыць анодам. Анод апускаюць у раствор сульфату медзі(II). Пры прапусканні току медзь на анодзе акісляецца, яе іоны пераходзяць у раствор, перамяшчаюцца да катода і на ім аднаўляюцца. Прымесі ў гэтым працэсе не ўдзельнічаюць з-за іх малой канцэнтрацыі, і таму на катодзе ўтвараецца слой чыстай медзі.
Працэсы электролізу з актыўнымі анодамі выкарыстоўваюць для атрымання пакрыццяў з аксідаў металаў. Так, пры правядзенні электролізу з анодам з алюмінію яго паверхня акісляецца, пакрываючыся слоем аксіду. Такі працэс спецыяльнага нарошчвання аксіду на паверхні металу называюць электрахімічным аксідзіраваннем (або анадзіраваннем). Анадзіраванне ўжываюць для абароны металу ад карозіі, надання яго паверхні дэкаратыўнага знешняга выгляду, павышанай цвёрдасці.
Метадам электролізу раствораў солей на паверхню розных вырабаў наносяць пакрыцці з металаў і іх сплаваў, кампазітаў з неметаламі, што надае вырабам патрэбныя ўласцівасці (павышаная каразійная ўстойлівасць, дэкаратыўнае аздабленне, электраправоднасць і інш.). Да распаўсюджаных прамысловых працэсаў адносяцца цынкаванне, нікеляванне, алавяненне, мядненне, храмаванне, залачэнне і серабрэнне.
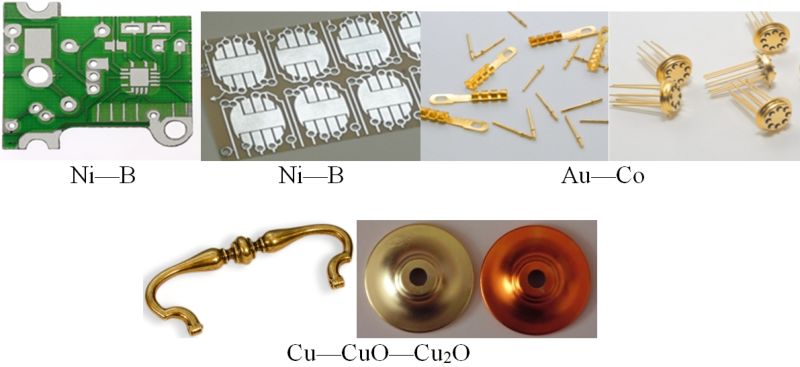
У НДІ фізіка-хімічных праблем Беларускага дзяржаўнага ўніверсітэта распрацаваны і ўкаранёны ў прамысловасць працэсы электрахімічнага асаджвання пакрыццяў са сплаваў металаў і кампазіцыйных пакрыццяў метал — аксід металу, напрыклад: Ni—B, Ni—P, Ni—Sn, Au—Co, Сu—CuO—Cu2O, Ni — алмаз (алмаз у выглядзе тонка здробненага парашку). Такія пакрыцці больш цвёрдыя, зноса- і каразійнаўстойлівыя, чым пакрыцці з індывідуальных металаў, маюць дэкаратыўны знешні выгляд (мал. 108.6).
Электроліз водных раствораў выкарыстоўваецца таксама ў сінтэзе розных неарганічных рэчываў, у апрацоўцы паверхняў металаў (азатаванне, барыраванне, электрапаліроўка, ачыстка), у ачыстцы сцёкавых вод (працэсы электракаагуляцыі, электраэкстракцыі, электрафлатацыі). Электролізам атрымліваюць кісларод і вадарод.
Пры электролізе водных раствораў солей на катодзе аднаўляюцца катыёны металаў, размешчаных у радзе актыўнасці пасля вадароду.
На катодзе не аднаўляюцца катыёны металаў IA- і IIA-груп, размешчаныя ў пачатку раду актыўнасці, а таксама алюміній, замест іх аднаўляецца вадарод з малекул вады.
На катодзе адначасова з вадародам з вады аднаўляюцца катыёны металаў, размешчаных у радзе актыўнасці паміж алюмініем і вадародам.
На анодзе ў растворах солей бескіслародных кіслот акісляюцца аніёны (акрамя фтарыд-іонаў).
На анодзе ў растворах солей кіслародзмяшчальных кіслот з максімальнай ступенню акіслення неметалу (,
) акісляюцца малекулы вады з вылучэннем кіслароду.
Пытанні, заданні, задачы
1. Якія з рэчываў — каменная соль, цукар, медны купарвас, гліцэрына, серная кіслата — могуць падвергнуцца электролізу ў водным растворы?
2. Растлумачце, чаму алюміній нельга атрымаць электролізам воднага раствору яго хларыду.
3. Прывядзіце ўраўненні рэакцый на электродах пры электролізе воднага раствору сульфату нікелю(II).
4. Параўнайце прадукты электролізу расплаву і воднага раствору хларыдаў натрыю, нікелю(II) і медзі(II). Прывядзіце адпаведныя ўраўненні хімічных рэакцый.
5. Пры электролізе воднага раствору хларыду натрыю без падзелу электродных прастор можна атрымаць гіпахларыт натрыю. Прывядзіце магчымыя ўраўненні электродных працэсаў і хімічных рэакцый у растворы.
6. Прадукцыяй цэха мембраннага электролізу ААТ «Беларуськалій» з’яўляюцца водны раствор гідраксіду калію і саляная кіслата. Прывядзіце ўраўненні рэакцый, якія ляжаць у аснове атрымання гэтых рэчываў.
7. Як зменіцца канцэнтрацыя катыёнаў і аніёнаў у водных растворах CuCl2, Na2SO4, KI, NaOH, HCl пры электролізе? Прывядзіце адпаведныя ўраўненні рэакцый.
8. У якасці лабараторнага спосабу дэзынфекцыі вады выкарыстоўваецца электроліз воднага раствору хларыду натрыю ў партатыўных электралізёрах. Растлумачце працэсы, на якіх заснаваны гэты спосаб дэзынфекцыі вады.
9. Сырцом для атрымання цынку з’яўляецца руда, якая ўтрымлівае цынкавую падманку (ZnS). Прадукт яе абпалу раствараюць у сернай кіслаце і пасля некалькіх стадый ачысткі ад прымесей (Cu2+, Fe2+, Fe3+ і інш.) падвяргаюць электролізу. Прывядзіце ўраўненні хімічных рэакцый, якія ілюструюць усе асноўныя стадыі атрымання цынку.
10. Аксід марганцу(IV) атрымліваюць электролізам раствору сульфату марганцу(II) у прысутнасці сернай кіслаты. Падумайце, якія працэсы працякаюць на электродах і прывядзіце ўраўненні адпаведных рэакцый.
Самакантроль
1. Пры электролізе водных раствораў солей аднаўляюцца іоны:
- а) Li+;
- б) Mg2+;
- в) Ni2+;
- г) Au3+.
2. Пры электролізе водных раствораў солей не аднаўляюцца іоны:
- а) K+;
- б) Са2+;
- в) Cu2+;
- г) Ag+.
3. Прадуктамі электролізу воднага раствору калійнай солі з’яўляюцца:
- а) K;
- б) NaOH;
- в) KОН;
- г) Н2.
4. На катодзе могуць працякаць працэсы:
- а) 2Н2О + 2e– = Н2↑ + 2ОН–;
- б) 2Н2О – 4e– = О2↑ + 4Н+;
- в) 2Н+ + 2e– = Н2↑;
- г) Ni2+ + 2e– = Ni0.
5. Пры электролізе воднага раствору хларыду натрыю вылучыўся вадарод аб’ёмам 2,24 дм3 (н. у.). Лік электронаў, аддадзеных пры гэтым іонамі хлору, роўны:
- а) 6,02 ∙ 1023;
- б) 3,01 ∙ 1023;
- в) 1,20 ∙ 1023;
- г) 1,02 ∙ 1023.