§ 41. Элементы IVA-групы. Вуглярод і крэмній
Аксіды вугляроду — вуглякіслы і чадны газы
Асаблівасці будовы і фізічныя ўласцівасці. Аксід вугляроду(IV), або вуглякіслы газ , з’яўляецца найвышэйшым аксідам вугляроду і адпавядае агульнай формуле ЭO2. Аксід вугляроду(IV) — рэчыва малекулярнай будовы. Малекула змяшчае дзве двайныя кавалентныя палярныя сувязі, але лінейная і таму непалярная (мал. 98, а).
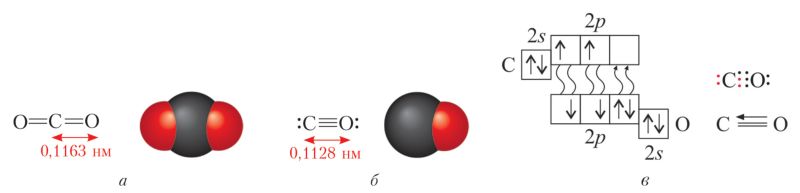
Успомнім, што вуглякіслы газ бясколерны, цяжэйшы за паветра (М(CO2) = 44 г/моль), часткова раствараецца ў вадзе. У 1 аб’ёме вады пры 20 °C раствараецца 0,88 аб’ёма СО2, але пры гэтым яго растваральнасць у 70 разоў вышэйшая за растваральнасць кіслароду і ў 150 разоў — азоту. Пры павышаным ціску (5 МПа) ён лёгка звадкоўваюцца і цвярдзее. Цвёрды аксід вугляроду(IV) — сухі лёд — узганяецца без плаўлення.
Аксід вугляроду(II) — чадны газ СО — таксама рэчыва малекулярнай будовы. Атамы ў малекуле звязаны вельмі трывалай трайной кавалентнай сувяззю, сувязь палярная, малекула ў цэлым таксама палярная (мал. 98, б). Газ бясколерны, дрэнна раствараецца ў вадзе, атрутны.
Хімічныя ўласцівасці аксіду вугляроду(IV). Вуглякіслы газ належыць да кіслотных аксідаў, таму ўступае ў рэакцыі з вадой, шчолачамі і асноўнымі аксідамі. З іншага боку, атамы вугляроду, якія маюць ступень акіслення +4, могуць удзельнічаць у рэакцыях, якія працякаюць з паніжэннем ступені акіслення: вуглякіслы газ уступае ў рэакцыі з моцнымі адноўнікамі. Так, падпаленыя магній або кальцый працягваюць гарэць у атмасферы вуглякіслага газу.
Рэакцыі без змены ступені акіслення
1. Рэакцыя з вадой. Пры прапусканні вуглякіслага газу праз ваду, у якую дададзены лакмус, афарбоўка мяняецца з фіялетавай на чырвоную — утвараецца вугальная кіслата:
.
2. Рэакцыя з растворамі шчолачаў прыводзіць да ўтварэння солей.
Як і ў выпадку з сярністым газам, састаў прадуктаў залежыць ад мольных суадносін рэагентаў.
Рэакцыя вуглякіслага газу з вапнавай вадой наглядна дэманструе паслядоўнасць утварэння солей пры прапусканні газу праз раствор шчолачы. Спачатку ўтвараецца асадак сярэдняй солі (якасная рэакцыя на СО2, Дадатак 3):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Пры далейшым прапусканні вуглякіслага газу асадак раствараецца з прычыны ўтварэння больш растваральнай кіслай солі:
СаСО3 + Н2О + СО2 = Са(НСО3)2.
3. З асноўнымі аксідамі вуглякіслы газ утварае солі:
СаО + СO2 = СаСO3.
Рэакцыі са змяненнем ступені акіслення — гэта, як было адзначана вышэй, рэакцыі вуглякіслага газу з адноўнікамі:
Хімічныя ўласцівасці аксіду вугляроду(II). Аксід вугляроду(II), або чадны газ СО, адносяць да нясолеўтваральных аксідаў. З іншага боку, атам вугляроду, маючы ступень акіслення +2, можа яе як павышаць, так і паніжаць. Пры павышэнні ступені акіслення ён праяўляе ўласцівасці адноўніку. Такія працэсы працякаюць пры выплаўленні металаў:
,
пры згаранні ў кіслародзе:
.
Угарны газ не рэагуе пры пакаёвай тэмпературы з растворам гідраксіду натрыю.
З расплавам гэтага гідраксіду ўтварае фарміят натрыю:
NaOH + СO HСООNa,
з якога дзеяннем сернай кіслаты атрымліваюць мурашыную кіслату.
Рэакцыя пачынаецца пры тэмпературы большай за 500 °С, а ў прысутнасці аксіду марганцу(IV) MnO2 як каталізатару працякае ўжо пры пакаёвай тэмпературы.
Паніжэнне ступені акіслення адбываецца ў рэакцыях з адноўнікам, а аксід вугляроду(II) пры гэтым праяўляе ўласцівасці акісляльніку. Прыклад такога ператварэння вам вядомы з курса арганічнай хіміі: узаемадзеянне чаднага газу з вадародам (адноўнікам) — найважнейшы спосаб атрымання спірту метанолу:
.
Як вуглякіслы, так і чадны газы забруджваюць атмасферу. Нагадаем, што аксід вугляроду(II) не выпадкова называецца чадным газам. Гэты аксід вельмі атрутны. Утвараючыся пры няпоўным згаранні паліва, ён можа прывесці да моцнага атручэння ці смяротнага зыходу. Адсутнасць паху робіць яго яшчэ больш небяспечным. Таксічнае дзеянне звязана з тым, што малекулы чаднага газу ўтвараюць трывалае злучэнне з малекуламі гемаглабіну ў крыві. Такім чынам яны блакуюць доступ кіслароду, перакрываюць клеткавае дыханне.
Асноўная крыніца СО ў атмасферы — выхлапныя газы рухавікоў унутранага згарання, крыніца СО2 — паліўна-энергетычны комплекс і металургічная прамысловасць. Назапашванне вуглякіслага газу спрыяе глабальнаму пацяпленню на Зямлі («парніковы эфект»). Успомнім, што СО2 паглынаецца ў працэсе фотасінтэзу. Таму высечка лясоў прыводзіць да зніжэння паглынання вуглякіслага газу зялёнымі раслінамі і негатыўна ўплывае на стан атмасферы Зямлі.