§ 41. Элементы IVA-групы. Вуглярод і крэмній
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 41. Элементы IVA-групы. Вуглярод і крэмній |
| Напечатано:: | Гость |
| Дата: | Вторник, 12 Август 2025, 09:52 |
Вуглярод і крэмній як хімічныя элементы

Вуглярод 6С і крэмній 14Si з’яўляюцца хімічнымі элементамі IVА-групы перыядычнай сістэмы, адносяцца да неметалаў. Акрамя іх група ўключае таксама германій 32Ge, волава 50Sn, свінец 82Pb і флеровій 114Fl.
На знешнім электронным слоі атамы ўтрымліваюць па 4 электроны, агульная электронная канфігурацыя якога ns2np2:
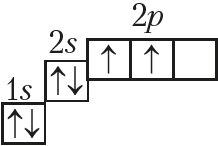
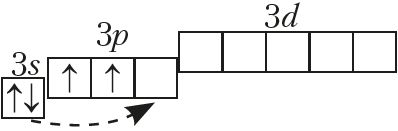
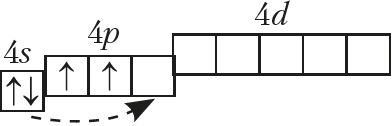
Неметалы Далучаючы электроны, атамы вугляроду і крэмнію праяўляюць адмоўную ступень акіслення –4, пры страце электронаў — +2 і +4.
Пры ўтварэнні хімічных сувязей атамаў вугляроду з атамамі іншых элементаў поўнай аддачы або поўнага далучэння чатырох электронаў не адбываецца, гэта значыць фарміруюцца пераважна кавалентныя сувязі.
У адрозненне ад іншых элементаў IVА-групы лік валентных электронаў вугляроду роўны ліку валентных арбіталей. Гэта адна з прычын вялікай устойлівасці сувязі C—C і схільнасці атамаў вугляроду злучацца адзін з адным у ланцугу:
 ,
,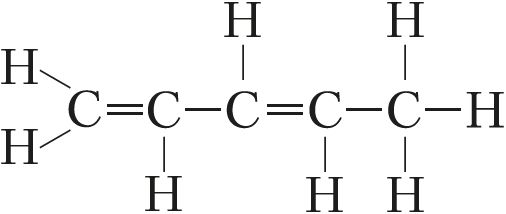 і інш.
і інш.Распаўсюджанасць у прыродзе. Крэмній — другі па распаўсюджанасці на Зямлі элемент. Вуглярод, паводле большасці ацэнак, займае 16-е месца. Звесткі аб прыродных злучэннях паказаны ў табліцы 30.
Табліца 30. Хімічныя элементы вуглярод і крэмній
| Элемент | Радыус атама, нм | χ | Ступені акіслення | Прыродныя злучэнні |
| Вуглярод 6С | 0,077 | 2,5 | –4, 0, +2, +4 | Простыя рэчывы — алмаз, графіт. Мел, мармур, вапняк, ракушачнік, жэмчуг, кальцыт (СаСО3); вуглякіслы газ, прыродны газ, нафта, арганічныя рэчывы |
| Kрэмній 14Si | 0,117 | 1,9 | ‒4, 0, +2, +4 | Крэменязём, кварц, горны крышталь (асноўны кампанент SiО2); сілікаты металаў |
Вуглярод і крэмній як простыя рэчывы. Вуглярод як простае рэчыва існуе ў выглядзе некалькіх алатропных мадыфікацый, найважнейшыя з якіх — алмаз, графіт, фулерэны. Крэмній алатропных мадыфікацый не ўтварае, існуе ў выглядзе аднаго простага рэчыва з алмазападобнай структурай.
Крышталічныя рашоткі алатропных мадыфікацый вугляроду паказаны на малюнку 38. З матэрыялу § 16 вы ўжо ведаеце, чаму алмаз — самае цвёрдае рэчыва, чаму графіт электраправодны і лёгка расслойваецца. Вам таксама вядома, што фулерэны складаюцца са сферычных малекул С60, С80 (гл. мал. 38).

Графен — алатропная мадыфікацыя вугляроду, утвораная слоем атамаў вугляроду таўшчынёй адзін атам. Матэрыял, які валодае ўнікальнымі ўласцівасцямі — высокай праводнасцю і трываласцю, гідрафобнасцю, адмысловымі аптычнымі ўласцівасцямі, — выклікаў цікавасць не толькі вучоных, але і тэхнолагаў, звязаных з вытворчасцю працэсараў.
Маюць вялікае значэнне і знаходзяць шырокае ўжыванне аморфныя формы вугляроду — драўняны вугаль, актываваны вугаль, сажа.
Крэмній, у адрозненне ад алмазу, з’яўляецца паўправадніком, што дазваляе шырока выкарыстоўваць яго ў сучасных мікрасхемах. Яго ўжываюць таксама ў вытворчасці гарачатрывалых сталей.
Такім чынам, асаблівасці будовы рэчываў вызначаюць іх уласцівасці, а значыць, і сферы выкарыстання.
Хімічныя ўласцівасці
Вуглярод і крэмній, як і пераважная колькасць іншых неметалаў, праяўляюць як акісляльныя (напрыклад, рэагуючы з металамі), так і аднаўленчыя ўласцівасці (у рэакцыях з кіслародам і фторам, некаторымі аксідамі):
Таксама ўспомнім, што вуглярод уступае ў рэакцыю з аксідам кальцыю:
,
а ўтвораны пры гэтым карбід выкарыстоўваюць для атрымання ацэтылену (напрыклад, для газавай зваркі):
.
Другой важнай рэакцыяй, вядомай вам з курса хіміі 9-га класа, з’яўляецца ўзаемадзеянне вугляроду і крэмнію пры высокіх тэмпературах:
.
Прадукт рэакцыі — карбарунд SiC валодае высокай цвёрдасцю і тэрмаўстойлівасцю, з прычыны чаго шырока выкарыстоўваецца як абразіўны і рэжучы матэрыял, канструкцыйны матэрыял у аўтамабілебудаванні, хімічнай прамысловасці, ядзернай энергетыцы. Паўправадніковыя ўласцівасці забяспечваюць яго выкарыстанне ў электроніцы і электратэхніцы, аптычныя — у дакладнай оптыцы і ювелірных вырабах (мал. 97.1).

У прамысловых маштабах карбарунд атрымліваюць пры тэмпературы 1600–2500 °С, выкарыстоўваючы ў якасці сыравіны аксід крэмнію(IV) і вуглярод:
SiO2 + 3C = SiC + 2CO↑.
Аксіды вугляроду — вуглякіслы і чадны газы
Асаблівасці будовы і фізічныя ўласцівасці. Аксід вугляроду(IV), або вуглякіслы газ , з’яўляецца найвышэйшым аксідам вугляроду і адпавядае агульнай формуле ЭO2. Аксід вугляроду(IV) — рэчыва малекулярнай будовы. Малекула змяшчае дзве двайныя кавалентныя палярныя сувязі, але лінейная і таму непалярная (мал. 98, а).
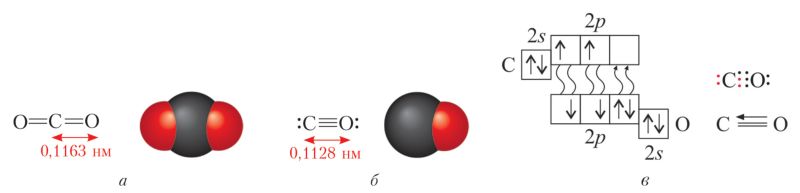
Успомнім, што вуглякіслы газ бясколерны, цяжэйшы за паветра (М(CO2) = 44 г/моль), часткова раствараецца ў вадзе. У 1 аб’ёме вады пры 20 °C раствараецца 0,88 аб’ёма СО2, але пры гэтым яго растваральнасць у 70 разоў вышэйшая за растваральнасць кіслароду і ў 150 разоў — азоту. Пры павышаным ціску (5 МПа) ён лёгка звадкоўваюцца і цвярдзее. Цвёрды аксід вугляроду(IV) — сухі лёд — узганяецца без плаўлення.
Аксід вугляроду(II) — чадны газ СО — таксама рэчыва малекулярнай будовы. Атамы ў малекуле звязаны вельмі трывалай трайной кавалентнай сувяззю, сувязь палярная, малекула ў цэлым таксама палярная (мал. 98, б). Газ бясколерны, дрэнна раствараецца ў вадзе, атрутны.
Хімічныя ўласцівасці аксіду вугляроду(IV). Вуглякіслы газ належыць да кіслотных аксідаў, таму ўступае ў рэакцыі з вадой, шчолачамі і асноўнымі аксідамі. З іншага боку, атамы вугляроду, якія маюць ступень акіслення +4, могуць удзельнічаць у рэакцыях, якія працякаюць з паніжэннем ступені акіслення: вуглякіслы газ уступае ў рэакцыі з моцнымі адноўнікамі. Так, падпаленыя магній або кальцый працягваюць гарэць у атмасферы вуглякіслага газу.
Рэакцыі без змены ступені акіслення
1. Рэакцыя з вадой. Пры прапусканні вуглякіслага газу праз ваду, у якую дададзены лакмус, афарбоўка мяняецца з фіялетавай на чырвоную — утвараецца вугальная кіслата:
.
2. Рэакцыя з растворамі шчолачаў прыводзіць да ўтварэння солей.
Як і ў выпадку з сярністым газам, састаў прадуктаў залежыць ад мольных суадносін рэагентаў.
Рэакцыя вуглякіслага газу з вапнавай вадой наглядна дэманструе паслядоўнасць утварэння солей пры прапусканні газу праз раствор шчолачы. Спачатку ўтвараецца асадак сярэдняй солі (якасная рэакцыя на СО2, Дадатак 3):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Пры далейшым прапусканні вуглякіслага газу асадак раствараецца з прычыны ўтварэння больш растваральнай кіслай солі:
СаСО3 + Н2О + СО2 = Са(НСО3)2.
3. З асноўнымі аксідамі вуглякіслы газ утварае солі:
СаО + СO2 = СаСO3.
Рэакцыі са змяненнем ступені акіслення — гэта, як было адзначана вышэй, рэакцыі вуглякіслага газу з адноўнікамі:
Хімічныя ўласцівасці аксіду вугляроду(II). Аксід вугляроду(II), або чадны газ СО, адносяць да нясолеўтваральных аксідаў. З іншага боку, атам вугляроду, маючы ступень акіслення +2, можа яе як павышаць, так і паніжаць. Пры павышэнні ступені акіслення ён праяўляе ўласцівасці адноўніку. Такія працэсы працякаюць пры выплаўленні металаў:
,
пры згаранні ў кіслародзе:
.
Угарны газ не рэагуе пры пакаёвай тэмпературы з растворам гідраксіду натрыю.
З расплавам гэтага гідраксіду ўтварае фарміят натрыю:
NaOH + СO HСООNa,
з якога дзеяннем сернай кіслаты атрымліваюць мурашыную кіслату.
Рэакцыя пачынаецца пры тэмпературы большай за 500 °С, а ў прысутнасці аксіду марганцу(IV) MnO2 як каталізатару працякае ўжо пры пакаёвай тэмпературы.
Паніжэнне ступені акіслення адбываецца ў рэакцыях з адноўнікам, а аксід вугляроду(II) пры гэтым праяўляе ўласцівасці акісляльніку. Прыклад такога ператварэння вам вядомы з курса арганічнай хіміі: узаемадзеянне чаднага газу з вадародам (адноўнікам) — найважнейшы спосаб атрымання спірту метанолу:
.
Як вуглякіслы, так і чадны газы забруджваюць атмасферу. Нагадаем, што аксід вугляроду(II) не выпадкова называецца чадным газам. Гэты аксід вельмі атрутны. Утвараючыся пры няпоўным згаранні паліва, ён можа прывесці да моцнага атручэння ці смяротнага зыходу. Адсутнасць паху робіць яго яшчэ больш небяспечным. Таксічнае дзеянне звязана з тым, што малекулы чаднага газу ўтвараюць трывалае злучэнне з малекуламі гемаглабіну ў крыві. Такім чынам яны блакуюць доступ кіслароду, перакрываюць клеткавае дыханне.
Асноўная крыніца СО ў атмасферы — выхлапныя газы рухавікоў унутранага згарання, крыніца СО2 — паліўна-энергетычны комплекс і металургічная прамысловасць. Назапашванне вуглякіслага газу спрыяе глабальнаму пацяпленню на Зямлі («парніковы эфект»). Успомнім, што СО2 паглынаецца ў працэсе фотасінтэзу. Таму высечка лясоў прыводзіць да зніжэння паглынання вуглякіслага газу зялёнымі раслінамі і негатыўна ўплывае на стан атмасферы Зямлі.
Аксід крэмнію(IV)
Аксід крэмнію(IV) — рэчыва немалекулярнай будовы, у яго крышталях кожны атам крэмнію акружаны чатырма атамамі кіслароду (мал. 99). Ён мае даволі высокую цвёрдасць; шырока распаўсюджана ў прыродзе (табл. 26, Дадатак 2).

Хімічныя ўласцівасці. Аксід крэмнію(IV) як кіслотны аксід рэагуе са шчолачамі і асноўнымі аксідамі:
З вадой аксід крэмнію(IV) не рэагуе.
Маючы найвышэйшую ступень акіслення, крэмній у складзе аксіду можа праяўляць акісляльныя ўласцівасці. Так, працэс аднаўлення крэмнію(IV) вугляродам выкарыстоўваюць для атрымання тэхнічнага крэмнію ў вытворчасці паўправадніковых матэрыялаў:
Адзін са значных напрамкаў прымянення аксіду крэмнію(IV) — атрыманне шкла спяканнем пяску SiО2, соды Na2CО3 і вапняку СаСО3:
Вуглярод і крэмній з’яўляюцца акісляльнікамі ў рэакцыях з металамі, але адноўнікамі ў рэакцыях з кіслародам. Аксід вугляроду(IV) — кіслотны аксід і акісляльнік. Аксід вугляроду(II) — нясолеўтваральны аксід і праяўляе як акісляльныя, так і аднаўленчыя ўласцівасці. Аксід крэмнію(IV) ужываюць у вытворчасці шкла.
Пытанні, заданні, задачы
1. Назавіце алатропныя мадыфікацыі вугляроду і сферы іх выкарыстання. Пракаментуйце з хімічнага пункту гледжання наступны тэкст: «Разнастайнасць яго ўласцівасцей здзіўляе: самы мяккі і звышцвёрды, эталон празрыстасці і абсалютнай чарнаты, цеплаізалятар і адзін з найлепшых праваднікоў цеплаты, дыэлектрык, праваднік і паўправаднік».
2. Складзіце формулу электроннай канфігурацыі і электронна-графічную схему крэмнію ў асноўным і ў адным з узбуджаных станаў.
3. Запішыце для элементаў з атамнымі нумарамі 6, 14, 32, 50 формулы:
- а) найвышэйшых аксідаў;
- б) лятучых вадародных злучэнняў.
4. Складзіце ўраўненні рэакцый:
- а) вугляроду з кіслародам, вадародам, берыліем (паказваючы ступені акіслення);
- б) вуглякіслага газу з вадой, аксідам барыю, гідраксідам калію;
- в) аксіду крэмнію(IV) з гідраксідам калію, аксідамі кальцыю і барыю.
5. Чаму ў атмасферы кіслароду аксід вугляроду(IV) не гарыць, а аксід вугляроду(II) згарае? Разлічыце аб’ём кіслароду (н. у.), неабходны для спальвання чаднага газу (н. у.) аб’ёмам 15 м3.
6. Па тэрмахімічным ураўненні вылічыце колькасць цеплаты, якое вылучылася пры згаранні чаднага газу аб’ёмам 1 м3 (н. у.).
7. Прапануйце фізічны і хімічны спосабы падзелу сумесі аксідаў вугляроду так, каб кожны з іх быў атрыманы асобна.
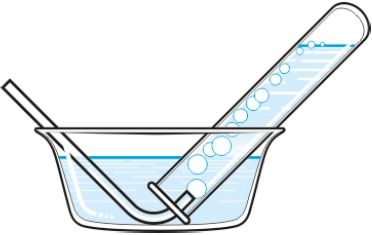
8. У посуд, запоўнены растворам гідраксіду натрыю, прапусцілі сумесь чаднага і вуглякіслага газаў. Чаму назіраецца памяншэнне памеру бурбалак газу з іх рухам у растворы? Якое рэчыва збіраецца ў прабірцы над водным растворам? Якія рэчывы прысутнічаюць у растворы?
9. Складзіце ўраўненні рэакцый паводле схемы:
- а)
;
- б)
.
10. Вуглякіслы газ аб’ёмам 0,784 дм3 (н. у.) быў цалкам паглынуты растворам, якія ўтрымліваў гідраксід натрыю хімічнай колькасцю 0,04 моль. Вызначце масы атрыманых солей.
*Самакантроль
1. Алатропнымі мадыфікацыямі вугляроду з’яўляюцца:
- а) сажа;
- б) графіт;
- в) драўнінны вугаль;
- г) алмаз.
2. Адносна крэмнію справядлівыя сцвярджэнні:
- а) існуе ў выглядзе алмазападобнай крышталічнай мадыфікацыі;
- б) выкарыстоўваецца ў якасці паўправадніка;
- в) у карбарундзе SiC яго атамы праяўляюць дадатную ступень акіслення;
- г) першы па распаўсюджанасці элемент у зямной кары?
3. Угарны газ рэагуе з:
- а) НСl;
- б) С;
- в) О2;
- г) Н2.
4. Паглынуць вуглякіслы газ можна, прапускаючы яго праз сасуд з:
- а) Р2О5;
- б) NaOH;
- в) СuSO4(бязводны);
- г) Н2SO4(канц).
5. Кіслотныя ўласцівасці вуглякіслага газу характарызуюць рэакцыі, выражаныя ўраўненнямі:
- а) СO2 + H2O
H2СO3;
- б) 2NaOH + СO2 = Na2СO3 + H2O;
- в) 6СО2 + 6Н2О = C6Н12O6 + 6O2 – Q;
- г) СO2 + 2Mg
C + 2MgO.