§ 38. Азотная кіслата
Хімічныя ўласцівасці
HNO3 — моцная аднаасноўная кіслата, праяўляе агульныя ўласцівасці кіслот, абумоўленыя іонам вадароду, а акісляльныя ўласцівасці — за кошт атама азоту ў досыць высокай ступені акіслення +5.
I. Агульныя хімічныя ўласцівасці. Да агульных хімічных уласцівасцей азотнай кіслаты адносяцца яе дзеянне на індыкатары і ўтварэнне солей. Змена афарбоўкі індыкатараў адбываецца за кошт іонаў вадароду Н+, што ўтвараюцца пры дысацыяцыі кіслаты:
.
Солі (нітраты) утвараюцца пры ўзаемадзеянні з асноўнымі і амфатэрнымі аксідамі (1), гідраксідамі металаў (2), іншымі солямі (3):
II. Акісляльныя ўласцівасці азотнай кіслаты. Гэтыя ўласцівасці HNO3 праяўляе ў рэакцыях з металамі, неметаламі, арганічнымі рэчывамі.
Яна акісляе металы, размешчаныя ў радзе актыўнасці як да вадароду, так і пасля вадароду, акрамя золата і плаціны. Так, пры ўзаемадзеянні канцэнтраванай азотнай кіслаты з меддзю і іншымі малаактыўны металамі (Ag, Hg і інш.) прадуктам аднаўлення з’яўляецца аксід азоту(IV) — буры газ:
,
а ў разбаўленай азотнай кіслаце — аксід азоту(II):
.
Састаў утвораных прадуктаў залежыць як ад канцэнтрацыі азотнай кіслаты, так і ад актыўнасці металу. Пры гэтым чым ніжэйшая канцэнтрацыя азотнай кіслаты і вышэйшая актыўнасць металу, тым мацней аднаўляецца азот.
З больш актыўнымі металамі прадуктамі аднаўлення могуць быць N2O, NO, NO2, N2, NH4NO3. У агульным выглядзе ўзаемадзеянне азотнай кіслаты з металамі можна паказаць схемай:
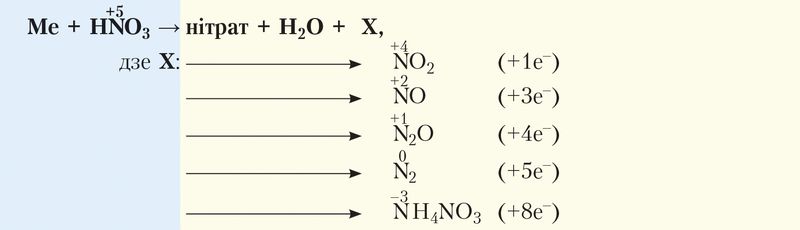
Як правіла, у рэакцыі ўтвараецца сумесь прадуктаў аднаўлення з перавагай асобных з іх.
Успомнім таксама (9-ы кл.), што канцэнтраваная азотная кіслата пры нізкіх тэмпературах не ўзаемадзейнічае з жалезам, хромам, алюмініем, кобальтам — пасівіруе іх. Акрамя металаў, азотная кіслата акісляе многія неметалы (C, S, P). Арганічныя рэчывы ў канцэнтраванай кіслаце могуць запальвацца (аміны, шкіпінар).