§ 38. Азотная кіслата
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 38. Азотная кіслата |
| Напечатано:: | Гость |
| Дата: | Понедельник, 11 Август 2025, 14:30 |
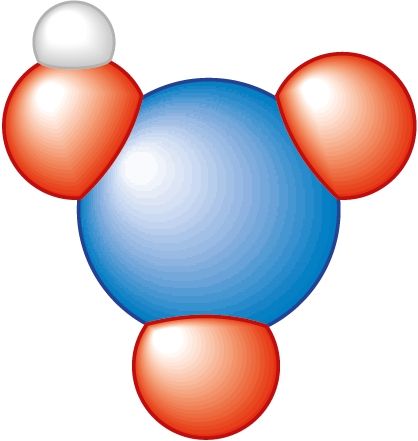
Азот утварае некалькі кіслот, найважнейшай з якіх з’яўляецца азотная кіслата HNO3. Ёй адпавядае аксід з атамамі азоту ў ступені акіслення +5: .
У малекуле кіслаты атам азоту ўтварае чатыры кавалентныя сувязі: тры з іх — па абменным механізме, а адну — па донарна-акцэптарным (гл. с. 86).
У адпаведнасці з гэтым структурная формула малекулы азотнай кіслаты мае выгляд:
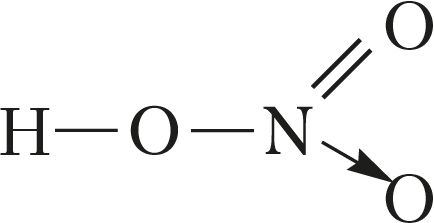 або
або 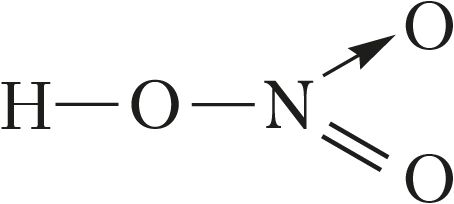
Пры гэтым атам азоту мае валентнасць IV, а ступень акіслення +5. Маштабная мадэль малекулы паказана на малюнку 95.
Атрыманне
У аснове прамысловага атрымання азотнай кіслаты ляжаць рэакцыі паслядоўнага акіслення аміяку, якія можна паказаць схемай:
і адлюстраваць ураўненнямі рэакцый:
1) каталітычнае акісленне аміяку:
;
2) самаадвольнае акісленне аксіду азоту(II):
;
3) паглынанне аксіду азоту(IV) вадой у прысутнасці кіслароду:
,
а таксама
.
У лабараторыі азотную кіслату можна атрымаць узаемадзеяннем цвёрдай солі (салетры — нітрату натрыю або калію) з канцэнтраванай сернай кіслатой:
.
Гэты спосаб прапанаваў яшчэ ў XVII стагоддзі нямецкі хімік і аптэкар Рудольф Глаўбер, а атрыманую кіслату назваў «спірытус нітры» — «дух салетры».
Фізічныя ўласцівасці
Азотная кіслата ў інтэрвале тэмператур ад –41,6 да 82,6 °С з’яўляецца вадкасцю. Пах рэзкі, задушлівы. Шчыльнасць — 1,51 г/см3 (меншая, чым у сернай, але вышэйшая, чым у салянай кіслаты). Змешваецца з вадой у любых суадносінах (неабмежаваная растваральнасць). Пры захоўванні можа быць злёгку афарбаваная ў буры колер з прычыны раскладання з утварэннем бурага газу NO2:
4HNO3 = 4NO2↑ + 2H2O + O2↑.
Хімічныя ўласцівасці
HNO3 — моцная аднаасноўная кіслата, праяўляе агульныя ўласцівасці кіслот, абумоўленыя іонам вадароду, а акісляльныя ўласцівасці — за кошт атама азоту ў досыць высокай ступені акіслення +5.
I. Агульныя хімічныя ўласцівасці. Да агульных хімічных уласцівасцей азотнай кіслаты адносяцца яе дзеянне на індыкатары і ўтварэнне солей. Змена афарбоўкі індыкатараў адбываецца за кошт іонаў вадароду Н+, што ўтвараюцца пры дысацыяцыі кіслаты:
.
Солі (нітраты) утвараюцца пры ўзаемадзеянні з асноўнымі і амфатэрнымі аксідамі (1), гідраксідамі металаў (2), іншымі солямі (3):
II. Акісляльныя ўласцівасці азотнай кіслаты. Гэтыя ўласцівасці HNO3 праяўляе ў рэакцыях з металамі, неметаламі, арганічнымі рэчывамі.
Яна акісляе металы, размешчаныя ў радзе актыўнасці як да вадароду, так і пасля вадароду, акрамя золата і плаціны. Так, пры ўзаемадзеянні канцэнтраванай азотнай кіслаты з меддзю і іншымі малаактыўны металамі (Ag, Hg і інш.) прадуктам аднаўлення з’яўляецца аксід азоту(IV) — буры газ:
,
а ў разбаўленай азотнай кіслаце — аксід азоту(II):
.
Састаў утвораных прадуктаў залежыць як ад канцэнтрацыі азотнай кіслаты, так і ад актыўнасці металу. Пры гэтым чым ніжэйшая канцэнтрацыя азотнай кіслаты і вышэйшая актыўнасць металу, тым мацней аднаўляецца азот.
З больш актыўнымі металамі прадуктамі аднаўлення могуць быць N2O, NO, NO2, N2, NH4NO3. У агульным выглядзе ўзаемадзеянне азотнай кіслаты з металамі можна паказаць схемай:
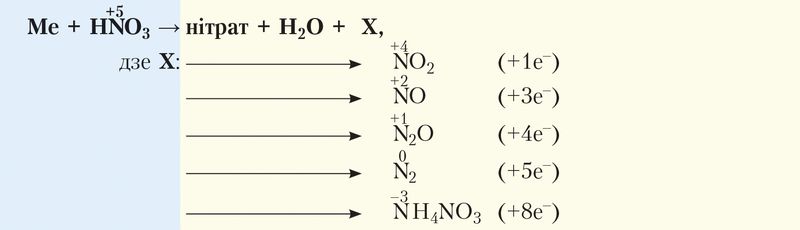
Як правіла, у рэакцыі ўтвараецца сумесь прадуктаў аднаўлення з перавагай асобных з іх.
Успомнім таксама (9-ы кл.), што канцэнтраваная азотная кіслата пры нізкіх тэмпературах не ўзаемадзейнічае з жалезам, хромам, алюмініем, кобальтам — пасівіруе іх. Акрамя металаў, азотная кіслата акісляе многія неметалы (C, S, P). Арганічныя рэчывы ў канцэнтраванай кіслаце могуць запальвацца (аміны, шкіпінар).
Прымяненне азотнай кіслаты
Азотную кіслату выкарыстоўваюць для атрымання нітратаў, напрыклад:
Яе шырока ўжываюць у арганічным сінтэзе.
Нітраваннем вуглевадародаў атрымліваюць нітразлучэнні (нітрабензол — зыходнае рэчыва для сінтэзу аніліну і фарбавальнікаў на яго аснове):
Пры ўзаемадзеянні з арганічнымі рэчывамі, якія змяшчаюць ОН-групы (гліцэрына, цэлюлоза), атрымліваюць нітраэфіры:
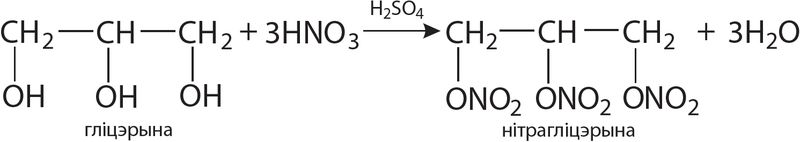
Нітрагліцэрыну (нітраэфір) выкарыстоўваюць у медыцыне і для атрымання шэрага гатункаў бяздымнага пораху.
Нітраты
Солі азотнай кіслаты ўсе без выключэння добра растваральныя ў вадзе. Найважнейшая хімічная ўласцівасць нітратаў — іх здольнасць раскладацца пры награванні з утварэннем кіслароду. Састаў утвораных прадуктаў залежыць ад актыўнасці металу.
1. Нітраты шчолачных і шчолачназямельных металаў утвараюць нітрыт і кісларод:
.
2. Нітраты металаў, размешчаных у радзе актыўнасці ад магнію да медзі, раскладаюцца з утварэннем аксіду металу, аксіду азоту(IV) і кіслароду:
.
3. Нітраты металаў, размешчаных у радзе актыўнасці пасля медзі, пры раскладанні ўтвараюць метал, аксід азоту(IV) і кісларод:
.
Тэрмічнае раскладанне нітратаў можна паказаць схемай:
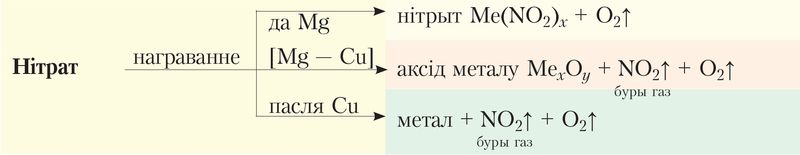
Вылучэнне кіслароду пры раскладанні дазваляе выявіць нітрат па «ўспышцы цвёрдай солі на распаленых вугольчыках» (Дадатак 3).
Варта адзначыць, што нітрат амонію, раскладаючыся пры тэмпературы не вышэйшай за 200 °С, кіслароду не ўтварае:
.
Выкарыстанне нітратаў. Нітраты натрыю, калію, кальцыю, амонію (NaNO3, KNO3, Са(NO3)2, NH4NO3) называюць салетрамі і выкарыстоўваюць у якасці ўгнаенняў. Яшчэ адзін важны напрамак выкарыстання нітратаў — піратэхніка: нітраты раскладаюцца пры награванні з вылучэннем кіслароду, які з’яўляецца моцным акісляльнікам, асабліва ў момант вылучэння. Кісларод пры гэтым служыць акісляльнікам іншых кампанентаў пораху.
Раскладанне нітрату натрыю можна выкарыстоўваць у лабараторыі для атрымання кіслароду:
(прадукты — кісларод і нітрыт натрыю — соль слабай азоцістай кіслаты).
Нітрат серабра(I) — складовую частку ляпісу — выкарыстоўваюць у медыцынскіх мэтах. У харчовай прамысловасці выкарыстоўваюць нітрат і нітрыт натрыю як кансерванты (Е251, Е250) для сыроў і каўбасных вырабаў. Мясным вырабам гэтыя солі надаюць яркі ружова-чырвоны колер. Гэтымі солямі карысталіся яшчэ старажытныя грэкі і егіпцяне.
Азотную кіслату ў прамысловасці атрымліваюць з аміяку. Яна акісляе ўсе металы, за выключэннем золата і плаціны. Пры ўзаемадзеянні медзі з канцэнтраванай азотнай кіслатой утвараецца, акрамя солі і вады, аксід азоту(IV) NO2, а з разбаўленай — аксід азоту(II).
Нітраты ўжываюць у якасці азотных угнаенняў. Выкарыстанне шматлікіх нітратаў у піратэхніцы заснавана на іх здольнасці раскладацца з вылучэннем кіслароду.
Пытанні, заданні, задачы
1. Выпішыце з тэксту параграфа восем формул нітратаў.
2. Пералічыце найважнейшыя фізічныя ўласцівасці азотнай кіслаты.
3. Укажыце афарбоўку раствору азотнай кіслаты пры дадаванні:
- а) лакмусу;
- б) метыларанжу.
4. Складзіце формулы нітратаў магнію, літыю, жалеза(III), барыю.
5. Прааналізуйце магчымасць працякання рэакцый у растворы паміж азотнай кіслатой і солямі: хларыд калію, карбанат калію, сульфід натрыю, сульфат натрыю.
6. Складзіце ўраўненні рэакцый у малекулярнай і іоннай формах паміж азотнай кіслатой і рэчывамі, формулы якіх: Fe2O3, Са(ОН)2, МgСО3.
7. Разлічыце масу солі, якую можна атрымаць у выніку ўзаемадзеяння медзі і раствору масай 50 г з масавай доляй азотнай кіслаты 60 % (кіслата канцэнтраваная).
8. Метадам электроннага балансу расстаўце каэфіцыенты ва ўраўненнях рэакцый з удзелам азотнай кіслаты:
- S + HNO3(канц) = H2SO4 + NO2↑ + H2O;
- Mg + HNO3(канц) = Mg(NO3)2 + N2↑ + H2O.
9. Запішыце ўраўненні рэакцый згодна са схемай:
- а)
;
- б)
.
10. Які мінімальны аб’ём раствору азотнай кіслаты з масавай доляй 80 % і шчыльнасцю 1,45 г/см3 неабходны для растварэння серабра масай 4,32 г? Рэакцыя працякае паводле схемы:
Ag + HNO3 → AgNO3 + NO2↑ + H2O.
*Самакантроль
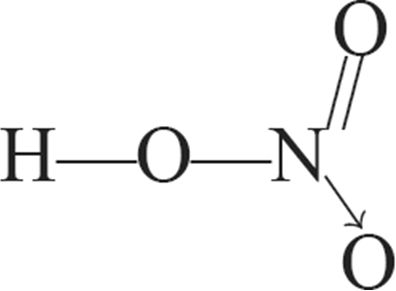
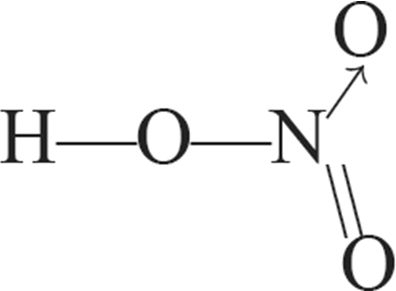
1. Структурныя формулы азотнай кіслаты:
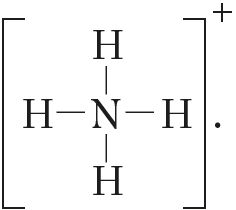
2. Правільнымі адносна азотнай кіслаты з’яўляюцца сцвярджэнні:
- а) двухасноўная;
- б) валентнасць азоту — IV;
- в) ступень акіслення атама азоту 4;
- г) моцны акісляльнік.
3. Прадуктамі ўзаемадзеяння разбаўленай азотнай кіслаты з меддзю з’яўляюцца:
- а) NO;
- б) H2O;
- в) NO2;
- г) Cu(NO3)2.
4. Азотная кіслата ўступае ў рэакцыі абмену з:
- а) Сu;
- б) CаO;
- в) Ca(OH)2;
- г) NH3.
5. Салетрамі называюць абедзве солі ў радзе:
- а) NH4NO3 і NH4Cl;
- б) NаNO3 і NH4НSO4;
- в) Cu(NO3)2 і AgNO3;
- г) NаNO3 і NH4NO3.