§ 33. Вадародныя злучэнні кіслароду і серы
Серавадарод
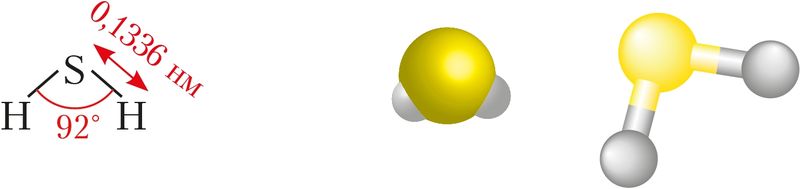
Будова малекулы. Будову малекулы серавадароду можна растлумачыць перакрыццём атамных 3р-арбіталей серы і 1s-арбіталі атамаў вадароду (§ 14, мал. 32). Пры гэтым адбываецца адштурхоўванне абласцей павышанай электроннай шчыльнасці, якія ўзніклі пры ўтварэнні σ-сувязі. У выніку гэтага валентны вугал крыху павялічваецца — узрастае ад 90°
Фізічныя ўласцівасці. Серавадарод — бясколерны газ з пахам тухлых яек. Ён цяжэйшы за паветра і мае больш нізкія тэмпературы кіпення (–60 °С) і плаўлення (–86 °С) у параўнанні з вадой. У адным аб’ёме вады раствараюцца тры аб’ёмы серавадароду. Пры гэтым утвараецца раствор вельмі слабай кіслаты — серавадароднай:
З ураўненняў дысацыяцыі вынікае, што кіслаце адпавядаюць два рады солей — кіслыя (гідрасульфіды, напрыклад NaHS, Ca(HS)2) і сярэднія (сульфіды, напрыклад Na2S, CaS).
Уплыў на арганізм чалавека. Серавадарод вельмі атрутны. Пры яго ўдыханні хутка адбываецца параліч дыхальных нерваў, чалавек перастае адчуваць пахі, што тоіць у сабе смяротную пагрозу. Трапляючы ў кроў, серавадарод разбурае гемаглабін і ўтварае сульфід жалеза чорнага колеру — «кроў чарнее». Працаваць з серавадародам у лабараторыях можна толькі ў выцяжной шафе.
У прыродзе серавадарод утвараецца ў невялікіх колькасцях пры гніенні бялкоў, утрымліваецца ў вулканічных газах, у атмасферы прамысловых рэгіёнаў. Серавадарод цяжэйшы за паветра, таму збіраецца ў каналізацыйных калодзежах, ямах. Налічваецца нямала выпадкаў, калі пацярпелымі станавіліся рабочыя, якія абслугоўваюць трубаправоды.
У арганізме серавадарод утвараецца з амінакіслаты — цыстэіну. Эндагенны (які выпрацаваўся ўнутры арганізма) серавадарод з’яўляецца спазмалітыкам — расслабляе гладкія мышцы, а таксама лічыцца адным з важных фактараў, якія абараняюць арганізм ад сардэчна-сасудзiстых захворванняў.
Прымяненне серавадароду і сульфідаў. Серавадарод знаходзіць абмежаванае прымяненне. Серавадародную ваду і газападобны серавадарод выкарыстоўваюць у аналітычнай хіміі для вызначэння (асаджэння) катыёнаў металаў, сульфіды якіх маларастваральныя і нерастваральныя.
Сульфіды многіх металаў ярка афарбаваныя: HgS, Ag2S, PbS, CuS — чорныя, Sb2S3 — аранжавы, CdS — жоўты, MnS — ружовы, ZnS — белы. Сульфіды шчолачных і шчолачназямельных металаў бясколерныя.
Адной з асноўных прычын пацямнення карцін старых майстроў з’яўляецца выкарыстанне імі свінцовых бялілаў. Узаемадзейнічаючы нават са следавымі колькасцямі серавадароду ў паветры, бялілы за некалькі стагоддзяў ператвараюцца ў чорны сульфід свінцу(II) PbS. Пры рэстаўрацыі яго акісляюць пераксідам вадароду: PbS(чорны) + 4H2O2 = PbSO4(белы) + 4H2O.
У тэхніцы сульфіды ўжываюць як крыніцы нецеплавога выпраменьвання — люмінафоры (CdS, ZnS), змазачныя матэрыялы (МоS2), паўправаднікі (CuS, CdS, PbS і іншыя).
У медыцыне выкарыстоўваюць штучныя і прыродныя серавадародныя ванны, серавадародную мінеральную ваду.
У хімічнай прамысловасці серавадарод служыць сыравінай для атрымання серы, сернай кіслаты, сульфідаў і серазмяшчальных арганічных злучэнняў. Напрыклад, меркаптаны як адны з самых смуродных рэчываў служаць дадаткам да прыроднага газу для выяўлення яго ўцечкі ў трубаправодах.