§ 20. Скорасць хімічных рэакцый

Адны хімічныя рэакцыі працякаюць хутка, іншыя — павольна. Так, працэс ператварэння драўніны ў каменны вугаль доўжыцца сотні мільёнаў гадоў (мал. 47, а). Ржаўленне вырабаў з жалеза пад дзеяннем вільготнага паветра ідзе многія гады (мал. 47, б). Гарэнне на паветры паперы (цэлюлозы) адбываецца за секунды (мал. 47, в). Практычна імгненна ідзе рэакцыя нейтралізацыі шчолачы моцнай кіслатой.
Такім чынам, хімічныя рэакцыі маюць розную скорасць. Скорасць хімічнай рэакцыі паказвае змяненне канцэнтрацыі рэчыва, што ўступае ў рэакцыю або ўтвараецца ў ёй, у адзінку часу. Гэта фізічная велічыня, абазначаецца літарай υ.
Скорасць рэакцый па меры іх працякання змяняецца. Таму звычайна кажуць аб сярэдняй скорасці рэакцыі ў вызначаны прамежак часу.
Для колькаснага вызначэння скорасці ў якасці прыкладу разгледзім гамагенную хімічную рэакцыю акіслення аксіду азоту(II) кіслародам да аксіду азоту(IV):
2NO + O2 = 2NO2.
У прамежак часу Δt = t2 – t1 колькасці (моль) зыходных рэчываў (рэагентаў) n(NO) і n(O2) памяншаюцца, а колькасць прадукту рэакцыі n(NO2) павялічваецца. Мы ведаем, што велічыня адносін колькасці n рэчыва X да аб’ёму рэакцыйнай сумесі V называецца малярнай канцэнтрацыяй с(X):
, прычым
.
Такім чынам, у рэакцыйнай сумесі пэўнага аб’ёму V змяненне колькасцей (моль) удзельнікаў рэакцыі прапарцыйнае змяненню іх малярных канцэнтрацый Δс.
Для вызначэння велічыні скорасці рэакцыі υ неабходна ведаць змяненне колькасці (моль) Δn = n2 – n1 аднаго з рэчываў (NO, O2 або NO2), тое, што адбылося ў прамежак часу Δt = t2 – t1, і аб’ём рэакцыйнай сумесі V.
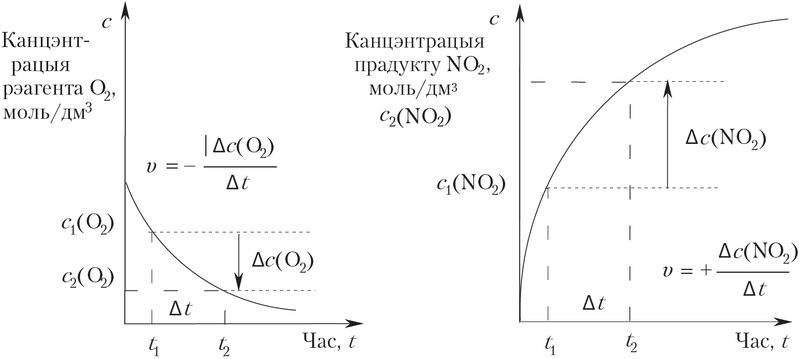
Матэматычны выраз скорасці рэакцыі ў адносінах да любога зададзенага ўдзельніка X можна паказаць наступным чынам:
дзе Δс(X) — змяненне малярнай канцэнтрацыі рэчыва X за час Δt.
Паколькі скорасць рэакцыі з’яўляецца дататнай велічынёй, а канцэнтрацыя рэагентаў NO і O2 памяншаецца, то ў выраз скорасці для зыходных рэчываў ставяць знак «мінус». Канцэнтрацыя прадуктаў узрастае, значыць, у выраз ставяць знак «плюс».
Калі каэфіцыенты ва ўраўненні хімічнай рэакцыі не роўныя адзінцы, то скорасць, вымераная для розных рэчываў, адрозніваецца.

Скорасць рэакцыі вызначаецца хімічнай прыродай рэагуючых рэчываў.
Рэчывы, якія ўступаюць у хімічныя рэакцыі, адрозніваюцца саставам і будовай, тыпам хімічнай сувязі, лікам і трываласцю гэтых сувязей. Як вынік, рэагенты валодаюць рознай рэакцыйнай здольнасцю. Разгледзім у якасці прыкладу скорасць узаемадзеяння розных металаў з моцнай і слабай кіслотамі.
Калі апусціць у прабіркі з разбаўленай салянай кіслатой кавалачкі магнію і жалеза аднолькавага памеру і формы, то можна ўбачыць, што ў прабірцы з магніем назіраецца бурнае вылучэнне вадароду і моцнае разаграванне. У прабірцы з жалезам бурбалкі газу вылучаюцца значна больш павольна, а тэмпература падымаецца толькі крыху. Значыць, скорасць узаемадзеяння металу з кіслатой залежыць ад яго актыўнасці.
Пры замене моцнай хлоравадароднай кіслаты на слабую воцатную кіслату той жа малярнай канцэнтрацыі скорасць рэакцыі магнію і жалеза істотна памяншаецца. Такім чынам, скорасць узаемадзеяння металу з кіслатой залежыць ад прыроды абодвух рэагентаў — як металу, так і кіслаты.

Для працякання хімічнай рэакцыі неабходна, каб рэагуючыя часціцы сутыкнуліся адна з другой. Аднак гэтай умовы недастаткова, таму што пры сутыкненні неабавязкова адбудзецца рэакцыя. Так, пры атмасферным ціску і пакаёвай тэмпературы кожная малекула ў розных газах (N2, O2, Ar і інш.) адчувае каля 5 млрд сутыкненняў штосекундна. Калі б усе сутыкненні часціц прыводзілі да хімічнай рэакцыі, то любое хімічнае ператварэнне завяршалася б за тысячныя долі секунды. Паколькі гэтага не адбываецца, значыць, не ўсе сутыкненні эфэктыўныя. Для таго каб хімічнае ператварэнне адбылося, часціцам неабходна валодаць энергіяй, дастатковай для разбурэння або перабудовы хімічных сувязей у зыходных рэчывах.
У працэсе хімічнага ўзаемадзеяння малекулы павінны прайсці праз асобы пераходны стан, у якім яны асабліва актыўныя. Для дасягнення такога стану патрабуецца затраціць энергію.
Энергія актывацыі — гэта мінімальная энергія, якую неабходна надаць часціцам рэагуючых рэчываў для пераводу ў актыўны стан, каб забяспечыць працяканне хімічнай рэакцыі пры іх сутыкненні (мал. 48).
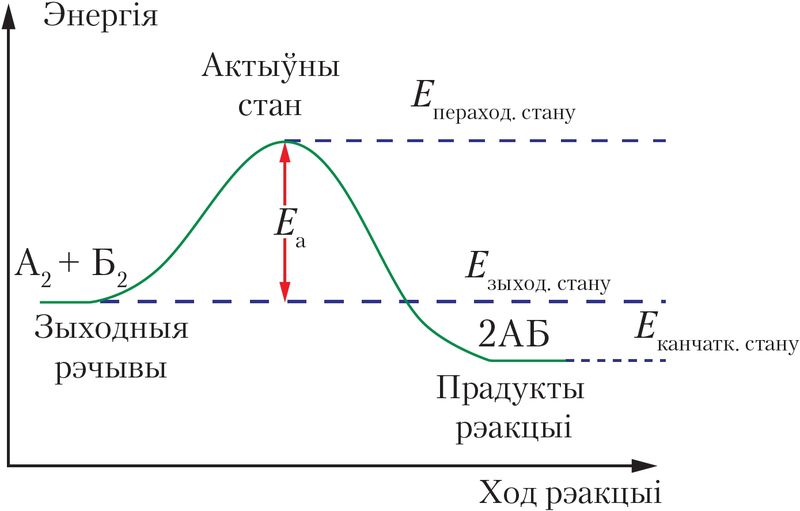
Пры аднолькавай тэмпературы скорасці хімічных рэакцый моцна адрозніваюцца ў асноўным з-за велічыні энергіі актывацыі, якая абазначаецца Еа (кДж/моль). Чым меншая велічыня Еа, тым больш нізкі «энергетычны бар’ер» патрабуецца пераадолець рэагентам і тым большая скорасць рэакцыі.
У шэрагу выпадкаў для ініцыявання экзатэрмічных рэакцый рэагенты неабходна спачатку разагрэць, каб перавесці рэагуючыя рэчывы ў актыўны стан. Напрыклад, запалка ўспыхне пры трэнні, а газавая гарэлка загарыцца ад падпаленай запалкі.