§ 17. Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
Пытанні, заданні, задачы
1. Апішыце ўтварэнне вадародных сувязей на прыкладзе:
- а) вады;
- б) фторавадароду:
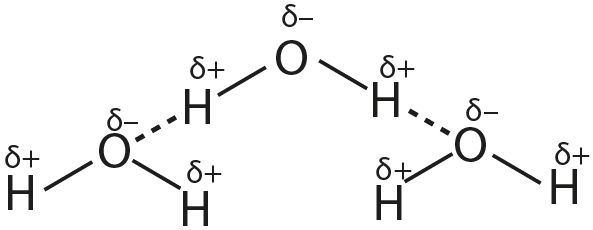
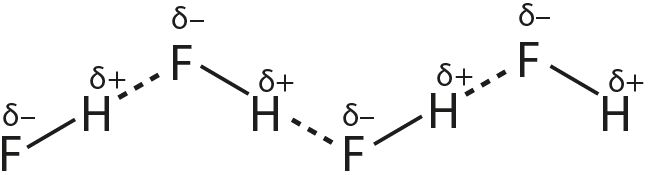
2. Прывядзіце прыклады рэчываў, пры растварэнні якіх у вадзе ўтвараюцца вадародныя сувязі паміж малекуламі вады і гэтага рэчыва.
3. Улічваючы, што ўтварэнне вадародных сувязей характэрна для малекул рэчываў, якія змяшчаюць групы ОН, растлумачце малую лятучасць і параўнальна высокую глейкасць сернай і фосфарнай кіслот.
4. Размясціце наступныя малекулы ў парадку павелічэння сіл міжмалекулярнага ўзаемадзеяння: Н2, He, F2, Br2, H2O. Параўнайце гэтыя рэчывы па тэмпературах кіпення.
5. Выпішыце назвы рэчываў, для якіх магчыма існаванне:
- а) міжмалекулярнай вадароднай сувязі — фторавадарод, метан, воцатная кіслата, прапанол-1, прапан;
- б) унутрымалекулярнай вадароднай сувязі — этыленгліколь, этанол, этан, поліпептыд, цэлюлоза.
6. Растлумачце, чаму тэмпература кіпення аміяку вышэйшая за тэмпературу кіпення фасфіну.
7. Растлумачце характар залежнасці тэмпературы кіпення вадароднага злучэння ЭHx ад парадкавага нумара р-элемента Э, выкарыстоўваючы даныя малюнка 44.
8. Чаму малекулярныя крышталічныя рэчывы, у адрозненне ад іонных, пасля плаўлення практычна не праводзяць электрычны ток?
9. Разлічыце колькасць рэчыва ў бруску лёду аб’ёмам 1 дм3. Шчыльнасць лёду — 0,917 г/см3.
10. Вызначце найпрасцейшую формулу рэчыва і адлюструйце схему ўтварэння вадародных сувязей паміж малекуламі рэчыва, у якім масавая доля вугляроду — 0,375, вадароду — 0,125, кіслароду — 0,500.