§ 17. Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 17. Міжмалекулярнае ўзаемадзеянне і вадародная сувязь |
| Напечатано:: | Гость |
| Дата: | Вторник, 12 Август 2025, 15:45 |
Міжмалекулярнае ўзаемадзеянне
Рэчывы малекулярнай будовы могуць існаваць у трох агрэгатных станах — цвёрдым, вадкім і газападобным. Але тэмпературныя ўмовы таго ці іншага стану для кожнага з рэчываў індывідуальныя.
Прычына тут адна — адрозненне ў сіле ўзаемадзеяння паміж малекуламі. Гэта ўзаемадзеянне называюць міжмалекулярным. Як і хімічная сувязь, міжмалекулярнае ўзаемадзеянне ажыццяўляецца за кошт сіл электрастатычнага прыцяжэння, але ў дзясяткі і сотні разоў больш слабых. Чым мацнейшае міжмалекулярнае ўзаемадзеянне ў рэчыве, тым вышэйшыя яго тэмпературы плаўлення і кіпення. Сіла міжмалекулярнага ўзаемадзеяння — індывідуальная характарыстыка рэчыва, яна залежыць ад электроннай будовы яго малекул.
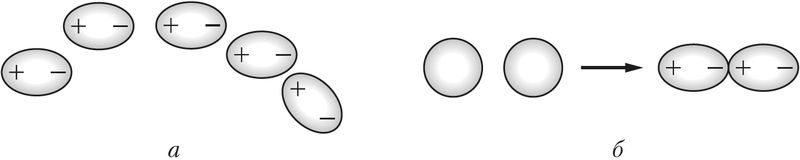
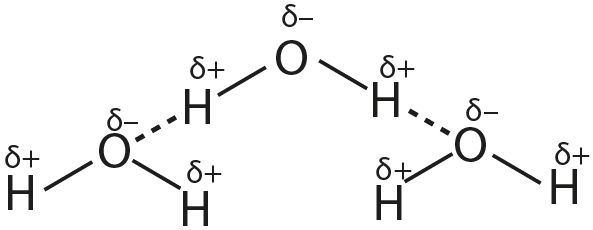
Малекула ў цэлым з’яўляецца электранейтральнай часціцай, але ўнутры малекулы знаходзяцца дадатна зараджаныя ядры, акружаныя электронамі. У залежнасці ад палярнасці і накіраванасці хімічных сувязей унутры малекулы на атамах могуць узнікаць зарады. Так, у малекуле HCl сувязь паміж атамамі палярная і агульная электронная пара зрушана да больш электраадмоўнага атама хлору. У выніку ў адной частцы малекулы — на атаме хлору — узнікае частковы адмоўны зарад, у другой — на атаме вадароду — частковы дадатны зарад. Утвараюцца дыполі . Паміж імі ўзнікае электрастатычнае прыцяжэнне (мал. 40, а; 41, а).
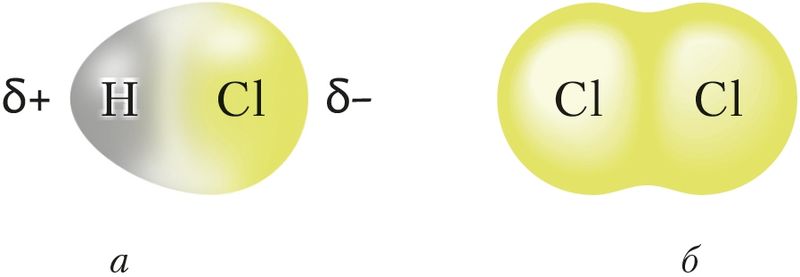
Слабае электрастатычнае прыцяжэнне існуе і паміж непалярнымі малекуламі, напрыклад хлору. Яно тлумачыцца ўтварэннем імгненных дыполяў у выніку руху электронаў у атамах, якія належаць суседнім малекулам (мал. 40, б; 41, б).
Варта мець на ўвазе, што малекулы з палярнымі сувязямі могуць быць у цэлым непалярнымі, гэта значыць не ўяўляць сабой дыполі. Напрыклад, малекулы маюць лінейную будову. Аднак малекулы вады ўяўляюць сабой дыполі, бо маюць вуглавую будову (мал. 33, с. 81).
Велічыня сіл міжмалекулярнага ўзаемадзеяння залежыць ад памераў малекул. Чым большая малекула, тым лягчэй яе знешнія электроны прыцягваюцца да іншай малекулы і тым больш трывалае міжмалекулярнае ўзаемадзеянне. Гэтым тлумачыцца пераход ад газападобнага (F2, Cl2) да вадкага (Br2) і цвёрдага (I2) станаў рэчыва ў радзе галагенаў. Як вядома, ад фтору да ёду па групе радыус атамаў расце. Адпаведна, растуць і памеры малекул, утвораных імі (табл. 14).
Табліца 14. Характарыстыкі малекул галагенаў
| Рэчыва | Фтор | Хлор | Бром | Ёд |
| Мадэлі малекул і іх памеры | 0,142 нм F2 |
0,198 нм Cl2 |
0,228 нм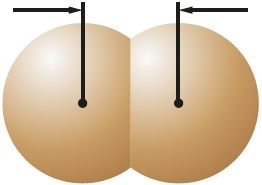 Br2 |
0,266 нм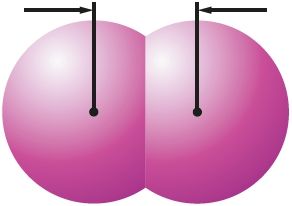 I2 |
| Тэмпературы кіпення, °C | –188,2 | –34,1 | +58,8 | +184,4 |
Вадародная сувязь
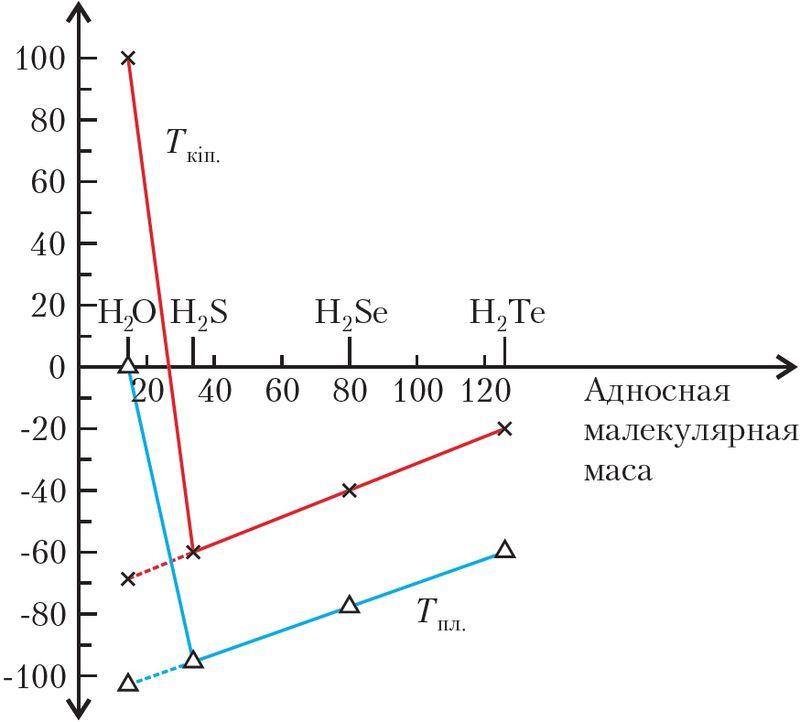
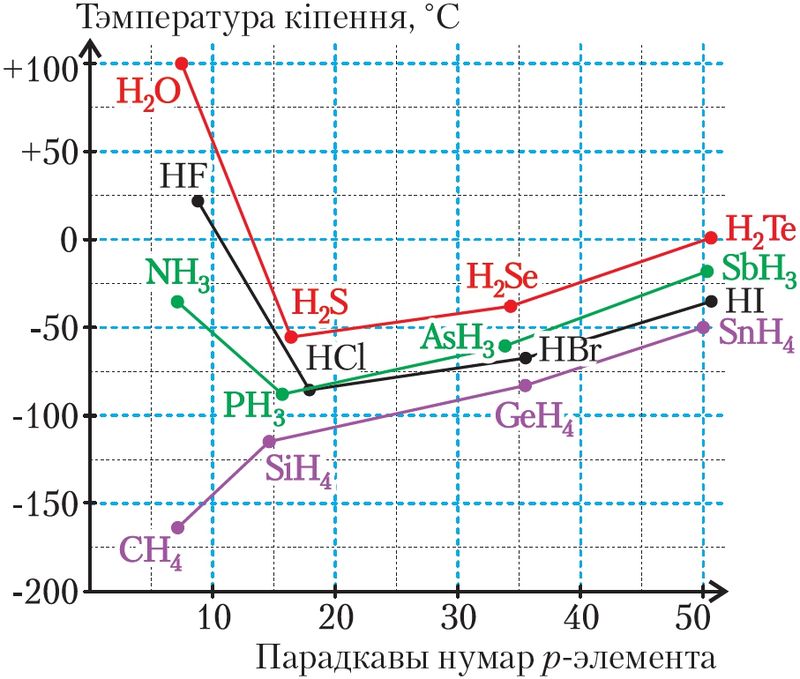
Пры вывучэнні арганічных рэчываў вы пазнаёміліся з заканамернасцю: чым большыя маса і памер малекулы, тым вышэйшыя тэмпературы плаўлення і кіпення малекулярнага рэчыва. Калі прытрымлівацца гэтай логікі, то паміж малекуламі вады міжмалекулярнае ўзаемадзеянне павінна быць слабейшае, чым паміж малекуламі вадародных злучэнняў іншых элементаў VIA-групы. У радзе H2O, H2S, H2Se, H2Te ў малекулы вады самая малая малекулярная маса — 18 а. а м. Вада павінна была б плавіцца пры тэмпературы прыкладна –100 °С, а кіпець — пры –80 °С. На самай справе тэмпературы плаўлення (0 °С) і кіпення (100 °С) вады анамальна высокія (мал. 42). Разбярэмся, у чым тут прычына.
Растлумачыць гэтую з’яву можна наяўнасцю, акрамя звычайных міжмалекулярных сувязей паміж малекуламі вады, дадатковага асаблівага тыпу міжмалекулярнага ўзаемадзеяння, якое атрымала назву вадародная сувязь.
Пад вадароднай разумеюць сувязь, што ўтварылася ў выніку электрастатычнага ўзаемадзеяння паміж атамам вадароду адной малекулы і больш электраадмоўным атамам другой малекулы, якія нясуць адмоўны зарад і маюць непадзеленую электронную пару.
Растлумачым механізм утварэння вадароднай сувязі з улікам электроннай і прасторавай будовы малекул вады (мал. 43, а).
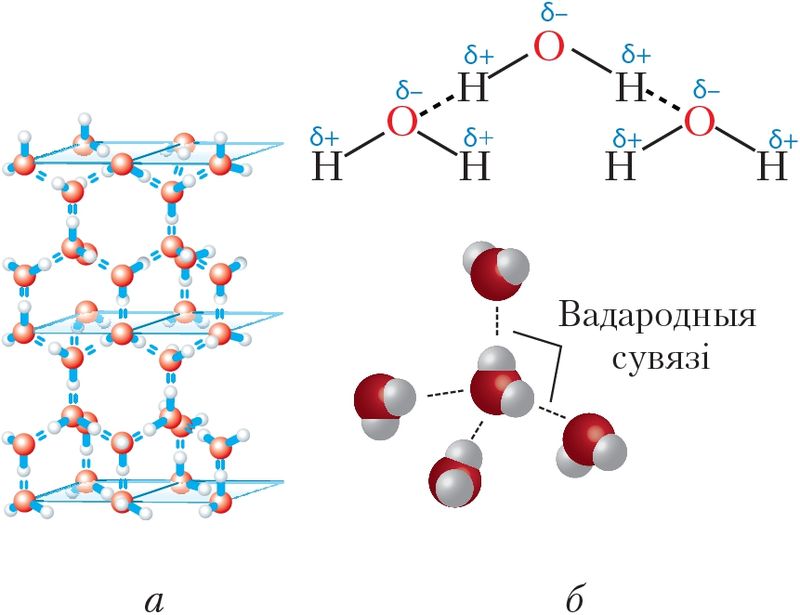
З-за палярнасці малекулы вады дадатна зараджаны атам вадароду адной малекулы прыцягваецца пад дзеяннем электрастатычных сіл да адмоўна зараджанага атама кіслароду другой малекулы (мал. 43, б). У гэтым узаемадзеянні прысутнічае і частковае кавалентнае звязванне паміж кіслародам і вадародам суседніх малекул па механізме донарна-акцэптарнага ўзаемадзеяння. Яно магчымае дзякуючы таму, што атам кіслароду ў малекуле вады ў значнай ступені адцягвае на сябе агульную электронную пару ад вадароду, як бы «спусташаючы» яго атамную арбіталь. На гэтай «пустой» арбіталі часткова размяшчаецца непадзеленая электронная пара атама кіслароду суседняй малекулы.
Вадародная сувязь прысутнічае ва ўсіх рэчывах, што змяшчаюць атамы вадароду, хімічна звязаныя з больш электраадмоўным атамам. Але яе праяўленне добра відаць пры значным адрозненні электраадмоўнасці вадароду і звязанага з ім кавалентнай сувяззю атама. Самыя моцныя вадародныя сувязі ўзнікаюць у прысутнасці самых электраадмоўных элементаў — фтору, кіслароду і азоту (мал. 44).
Вадародная сувязь мае энергію парадку 20–160 кДж/моль, што значна ніжэй за энергію хімічнай сувязі (парадку 400–900 кДж/моль) і вышэй за энергію міжмалекулярнага ўзаемадзеяння (2–10 кДж/моль).
Унікальнасць вады заключаецца ў тым, што малекулы Н2О здольныя ўтвараць разгалінаваную сетку вадародных сувязей — чатыры на адну малекулу (мал. 43, б). Дзякуючы вадародным сувязям вада валодае здольнасцю існаваць ва ўмовах Зямлі адразу ў трох агрэгатных станах — цвёрдым, вадкім і газападобным. Пры гэтым тэмпературны дыяпазон ад 0 да 100 °С спрыяльны для існавання ўсяго жывога на планеце. Дзякуючы чатыром вадародным сувязям малекулы вады ў цвёрдым стане ўтвараюць ажурную крышталічную структуру лёду, якая падобна на структуру алмазу (мал. 43, а). Поласці ў гэтай структуры робяць лёд менш шчыльным, чым вадкая вада, таму лёд не тоне і, пакрываючы вадаёмы, не дае ім прамерзнуць да дна.
Трывалыя вадародныя сувязі ўтвараюцца не толькі ў вадзе, але і паміж малекуламі неарганічных і карбонавых кіслот, фенолаў, спіртоў, аміяку, амінаў.
Рэчывы, здольныя ўтвараць міжмалекулярныя вадародныя сувязі, звычайна прыкметна растваральныя ў вадзе, маюць адносна высокія тэмпературы плаўлення і кіпення, а таксама значную глейкасць, напрыклад гліцэрына і фосфарная кіслата.
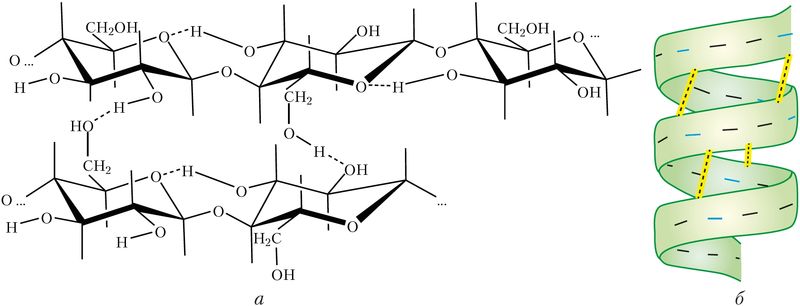
Вадародныя сувязі могуць быць не толькі міжмалекулярныя, але і ўнутрымалекулярныя. Так, макрамалекулы цэлюлозы ўяўляюць сабой доўгія ланцугі з унутрымалекулярнымі вадароднымі сувязямі, выкладзенымі паралельна і злучанымі паміж сабой мноствам міжмалекулярных вадародных сувязей. Гэта надае цэлюлозе механічную трываласць пры захаванні эластычнасці (мал. 45, а). Вадародныя сувязі вызначаюць фарміраванне другаснай структуры макрамалекул бялку (мал. 45, б).
Агрэгатны стан малекулярных рэчываў вызначаецца сіламі міжмалекулярнага ўзаемадзеяння.
Сілы міжмалекулярнага ўзаемадзеяння маюць электрастатычную прыроду, але значна слабейшыя за хімічную сувязь.
Вадародная сувязь — гэта электрастатычнае ўзаемадзеянне паміж атамам вадароду адной малекулы і больш электраадмоўным атамам другой малекулы, якія нясуць адмоўны зарад і маюць непадзеленую электронную пару. Вадародныя сувязі могуць быць і ўнутрымалекулярнымі.
Пытанні, заданні, задачы
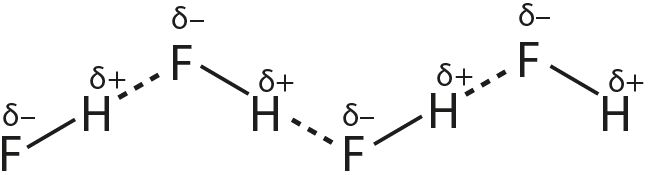
1. Апішыце ўтварэнне вадародных сувязей на прыкладзе:
- а) вады;
- б) фторавадароду:
2. Прывядзіце прыклады рэчываў, пры растварэнні якіх у вадзе ўтвараюцца вадародныя сувязі паміж малекуламі вады і гэтага рэчыва.
3. Улічваючы, што ўтварэнне вадародных сувязей характэрна для малекул рэчываў, якія змяшчаюць групы ОН, растлумачце малую лятучасць і параўнальна высокую глейкасць сернай і фосфарнай кіслот.
4. Размясціце наступныя малекулы ў парадку павелічэння сіл міжмалекулярнага ўзаемадзеяння: Н2, He, F2, Br2, H2O. Параўнайце гэтыя рэчывы па тэмпературах кіпення.
5. Выпішыце назвы рэчываў, для якіх магчыма існаванне:
- а) міжмалекулярнай вадароднай сувязі — фторавадарод, метан, воцатная кіслата, прапанол-1, прапан;
- б) унутрымалекулярнай вадароднай сувязі — этыленгліколь, этанол, этан, поліпептыд, цэлюлоза.
6. Растлумачце, чаму тэмпература кіпення аміяку вышэйшая за тэмпературу кіпення фасфіну.
7. Растлумачце характар залежнасці тэмпературы кіпення вадароднага злучэння ЭHx ад парадкавага нумара р-элемента Э, выкарыстоўваючы даныя малюнка 44.
8. Чаму малекулярныя крышталічныя рэчывы, у адрозненне ад іонных, пасля плаўлення практычна не праводзяць электрычны ток?
9. Разлічыце колькасць рэчыва ў бруску лёду аб’ёмам 1 дм3. Шчыльнасць лёду — 0,917 г/см3.
10. Вызначце найпрасцейшую формулу рэчыва і адлюструйце схему ўтварэння вадародных сувязей паміж малекуламі рэчыва, у якім масавая доля вугляроду — 0,375, вадароду — 0,125, кіслароду — 0,500.
*Самакантроль
1. Міжмалекулярнае ўзаемадзеянне ўзмацняецца ў радах:
- а) С2Н6, СН4, С6Н14;
- б) С2Н6, С6Н14, С15Н32;
- в) Н2S, Н2Se, Н2Te;
- г) С2Н5OH, С4Н10, С15Н32.
2. На малюнку паказана ўтварэнне вадароднай сувязі паміж:
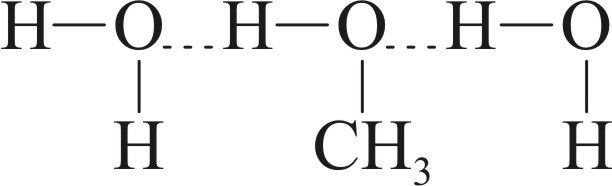
- а) малекуламі воды;
- б) малекуламі вады і карбонавай кіслаты;
- в) малекуламі вады і спірту;
- г) малекуламі спірту.
3. Першае рэчыва за кошт вадароднай сувязі мае большую тэмпературу кіпення, чым другое, у парах:
- а) SiH4 і СH4;
- б) HF і HCl;
- в) О2 і N2;
- г) С2Н5ОН і С4Н10.
4. Утварэнне ўнутрымалекулярнай сувязі адлюстроўваюць схемы:
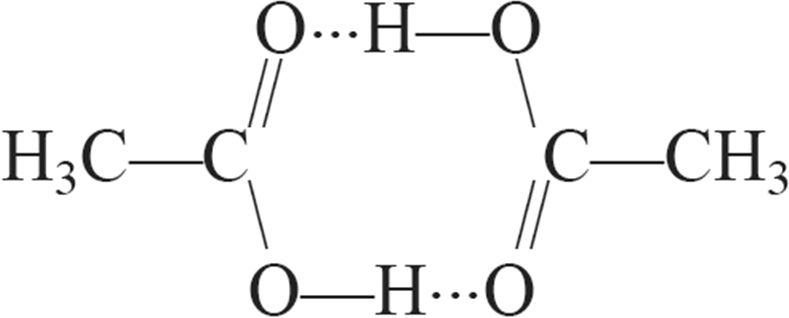
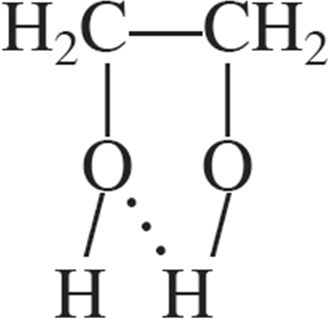
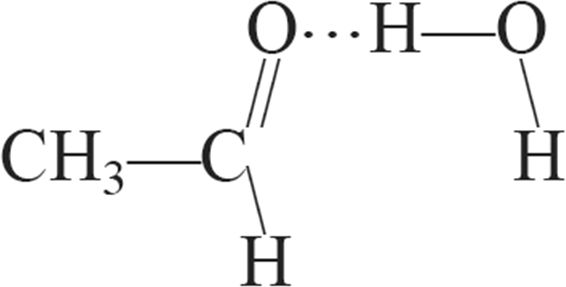
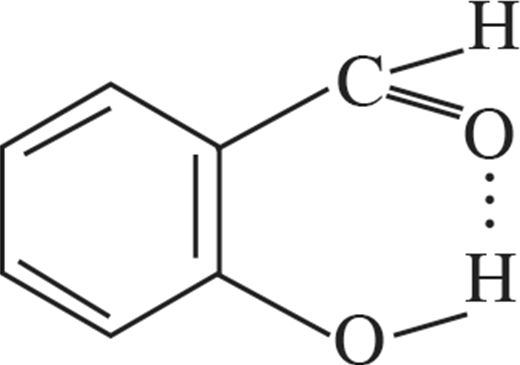
5. Узмацненне міжмалекулярнага ўзаемадзеяння прыводзіць да:
- а) паніжэння лятучасці рэчываў;
- б) зніжэнні інтэнсіўнасці паху;
- в) паніжэння тэмпературы кіпення;
- г) павышэння тэмпературы плаўлення.