§ 17. Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
Вадародная сувязь
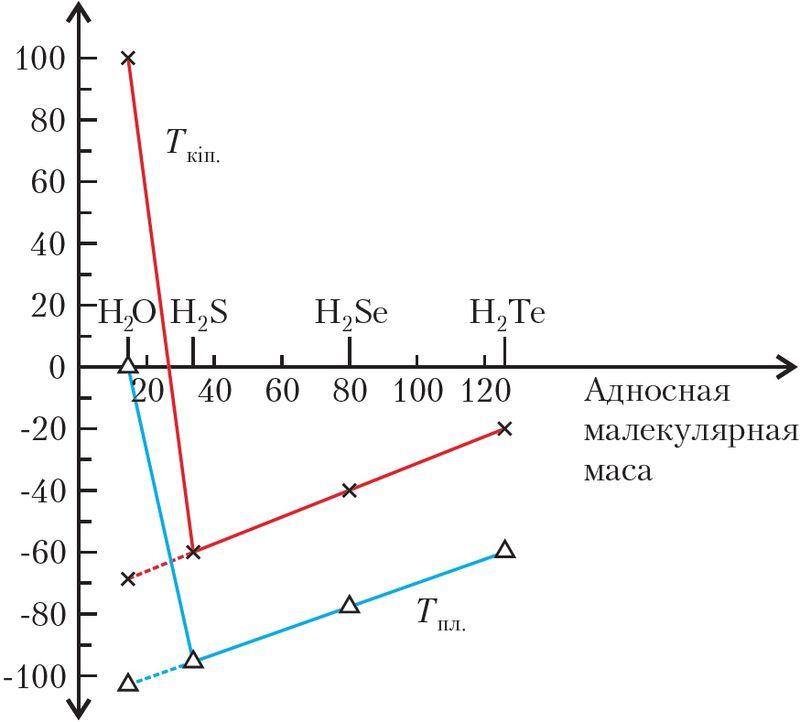
Пры вывучэнні арганічных рэчываў вы пазнаёміліся з заканамернасцю: чым большыя маса і памер малекулы, тым вышэйшыя тэмпературы плаўлення і кіпення малекулярнага рэчыва. Калі прытрымлівацца гэтай логікі, то паміж малекуламі вады міжмалекулярнае ўзаемадзеянне павінна быць слабейшае, чым паміж малекуламі вадародных злучэнняў іншых элементаў VIA-групы. У радзе H2O, H2S, H2Se, H2Te ў малекулы вады самая малая малекулярная маса — 18 а. а м. Вада павінна была б плавіцца пры тэмпературы прыкладна –100 °С, а кіпець — пры –80 °С. На самай справе тэмпературы плаўлення (0 °С) і кіпення (100 °С) вады анамальна высокія (мал. 42). Разбярэмся, у чым тут прычына.
Растлумачыць гэтую з’яву можна наяўнасцю, акрамя звычайных міжмалекулярных сувязей паміж малекуламі вады, дадатковага асаблівага тыпу міжмалекулярнага ўзаемадзеяння, якое атрымала назву вадародная сувязь.
Пад вадароднай разумеюць сувязь, што ўтварылася ў выніку электрастатычнага ўзаемадзеяння паміж атамам вадароду адной малекулы і больш электраадмоўным атамам другой малекулы, якія нясуць адмоўны зарад і маюць непадзеленую электронную пару.
Растлумачым механізм утварэння вадароднай сувязі з улікам электроннай і прасторавай будовы малекул вады (мал. 43, а).
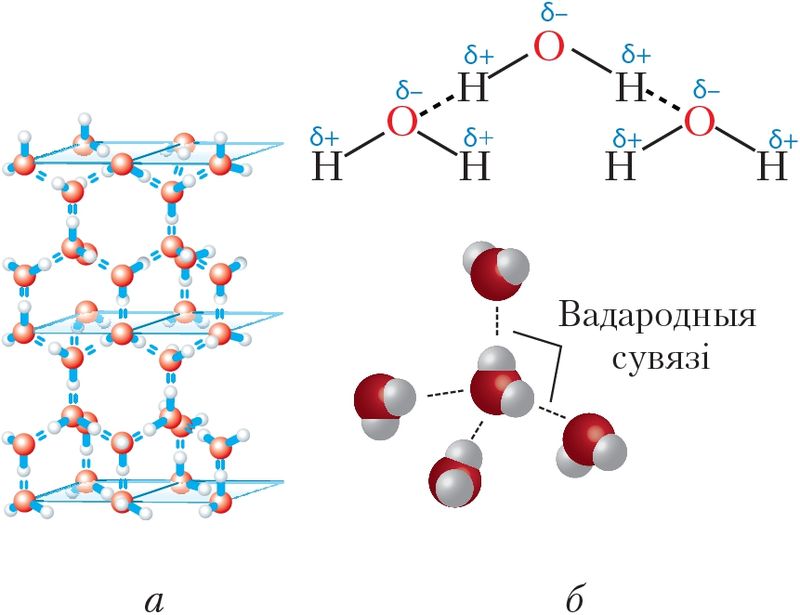
З-за палярнасці малекулы вады дадатна зараджаны атам вадароду адной малекулы прыцягваецца пад дзеяннем электрастатычных сіл да адмоўна зараджанага атама кіслароду другой малекулы (мал. 43, б). У гэтым узаемадзеянні прысутнічае і частковае кавалентнае звязванне паміж кіслародам і вадародам суседніх малекул па механізме донарна-акцэптарнага ўзаемадзеяння. Яно магчымае дзякуючы таму, што атам кіслароду ў малекуле вады ў значнай ступені адцягвае на сябе агульную электронную пару ад вадароду, як бы «спусташаючы» яго атамную арбіталь. На гэтай «пустой» арбіталі часткова размяшчаецца непадзеленая электронная пара атама кіслароду суседняй малекулы.
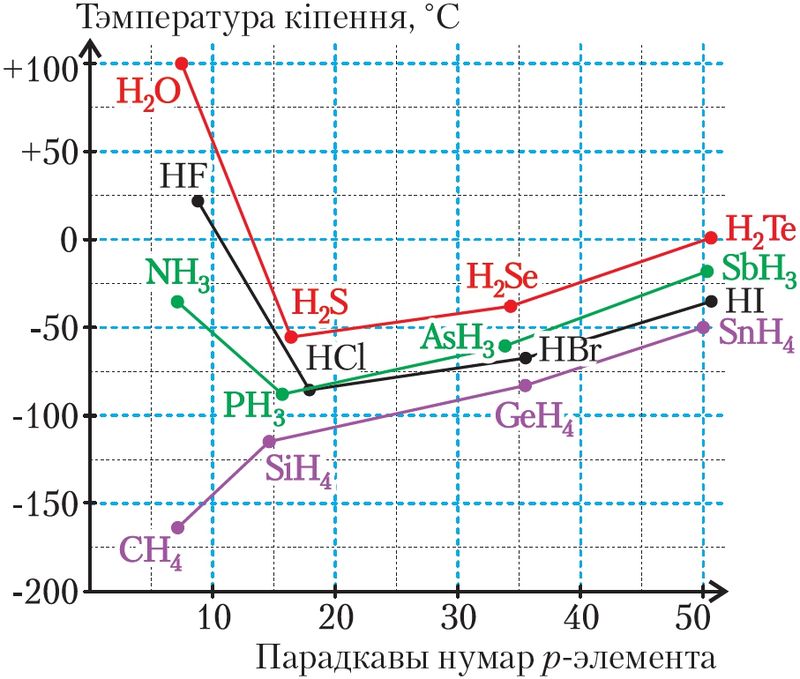
Вадародная сувязь прысутнічае ва ўсіх рэчывах, што змяшчаюць атамы вадароду, хімічна звязаныя з больш электраадмоўным атамам. Але яе праяўленне добра відаць пры значным адрозненні электраадмоўнасці вадароду і звязанага з ім кавалентнай сувяззю атама. Самыя моцныя вадародныя сувязі ўзнікаюць у прысутнасці самых электраадмоўных элементаў — фтору, кіслароду і азоту (мал. 44).
Вадародная сувязь мае энергію парадку 20–160 кДж/моль, што значна ніжэй за энергію хімічнай сувязі (парадку 400–900 кДж/моль) і вышэй за энергію міжмалекулярнага ўзаемадзеяння (2–10 кДж/моль).
Унікальнасць вады заключаецца ў тым, што малекулы Н2О здольныя ўтвараць разгалінаваную сетку вадародных сувязей — чатыры на адну малекулу (мал. 43, б). Дзякуючы вадародным сувязям вада валодае здольнасцю існаваць ва ўмовах Зямлі адразу ў трох агрэгатных станах — цвёрдым, вадкім і газападобным. Пры гэтым тэмпературны дыяпазон ад 0 да 100 °С спрыяльны для існавання ўсяго жывога на планеце. Дзякуючы чатыром вадародным сувязям малекулы вады ў цвёрдым стане ўтвараюць ажурную крышталічную структуру лёду, якая падобна на структуру алмазу (мал. 43, а). Поласці ў гэтай структуры робяць лёд менш шчыльным, чым вадкая вада, таму лёд не тоне і, пакрываючы вадаёмы, не дае ім прамерзнуць да дна.
Трывалыя вадародныя сувязі ўтвараюцца не толькі ў вадзе, але і паміж малекуламі неарганічных і карбонавых кіслот, фенолаў, спіртоў, аміяку, амінаў.
Рэчывы, здольныя ўтвараць міжмалекулярныя вадародныя сувязі, звычайна прыкметна растваральныя ў вадзе, маюць адносна высокія тэмпературы плаўлення і кіпення, а таксама значную глейкасць, напрыклад гліцэрына і фосфарная кіслата.
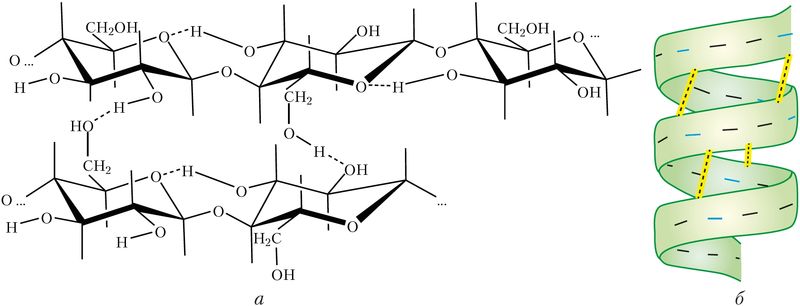
Вадародныя сувязі могуць быць не толькі міжмалекулярныя, але і ўнутрымалекулярныя. Так, макрамалекулы цэлюлозы ўяўляюць сабой доўгія ланцугі з унутрымалекулярнымі вадароднымі сувязямі, выкладзенымі паралельна і злучанымі паміж сабой мноствам міжмалекулярных вадародных сувязей. Гэта надае цэлюлозе механічную трываласць пры захаванні эластычнасці (мал. 45, а). Вадародныя сувязі вызначаюць фарміраванне другаснай структуры макрамалекул бялку (мал. 45, б).