§ 16. Тыпы крышталічных структур
Залежнасць уласцівасцей рэчываў ад тыпу крышталічнай структуры
Уласцівасці цвёрдых рэчываў залежаць ад будовы крышталёў і трываласці хімічных сувязей у іх. Напрыклад, вуглярод утварае некалькі разнавіднасцей крышталічных структур. Адна з іх — структура алмазу, у якой кожны атам вугляроду ўтварае чатыры роўныя па трываласці кавалентныя сувязі з чатырма суседнімі атамамі вугляроду, размешчанымі ў вяршынях тэтраэдра (мал. 38). Дзякуючы сваёй будове алмаз — самае цвёрдае прыроднае рэчыва (Дадатак 2). Аналагічныя крышталічныя структуры і блізкую да алмаза цвёрдасць маюць карбарунд SiC і боразон BN.
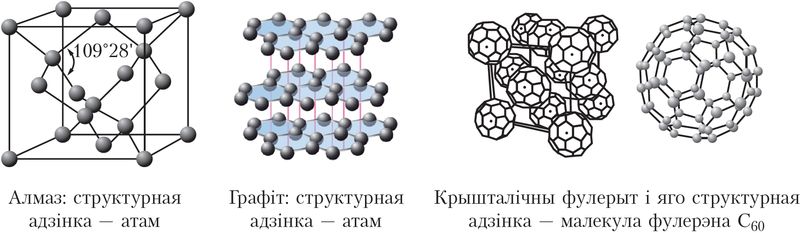
Другая разнавіднасць крышталічнага вугляроду — графіт. У графіце атамы вугляроду размешчаны слаямі. У слаях кожны атам вугляроду выкарыстоўвае тры свае электроны для ўтварэння трох кавалентных сувязей з суседнімі атамамі. Чацвёрты электрон удзельнічае ва ўтварэнні дылакалізаваных π-сувязей і можа свабодна перамяшчацца ўздоўж слоя. Таму графіт валодае электраправоднасцю і выкарыстоўваецца для вырабу электракантактаў, змазак, што праводзяць ток, электродаў і інш.
Адлегласць паміж слаямі графіту значна большая, чым паміж атамамі ў слоі, таму графіт лёгка расслойваецца. Дзякуючы гэтай уласцівасці з графіту вырабляюць грыфель алоўкаў, ён уваходзіць у састаў розных змазак, якія зніжаюць трэнне, і сам з’яўляецца цвёрдай змазкай у формах для ліцця металаў.
Трэцяя крышталічная мадыфікацыя вугляроду — фулерыт — утворана малекуламі фулерэну С60, якія складаюцца з 60 атамаў вугляроду.
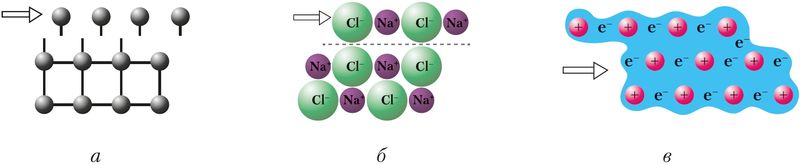
Атамныя, іонныя і металічныя крышталі адрозніваюцца ўстойлівасцю да механічнай дэфармацыі, у выніку якой адбываецца зрушванне асобных слаёў крышталічнай структуры (мал. 39). Пры гэтым счапленне паміж слаямі ў атамных крышталях (а) парушаецца з-за разрыву хімічных сувезей паміж атамамі, а ў іонных — з-за адштурхоўвання аднайменна зараджаных іонаў (б). У металічных крышталях дзякуючы асаблівасцям металічнай сувязі крышталі не разбураюцца, а дэфармуюцца. Таму металы пластычныя (коўкія), а атамныя і іонныя крышталі — крохкія.