§ 16. Тыпы крышталічных структур
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 16. Тыпы крышталічных структур |
| Напечатано:: | Гость |
| Дата: | Пятница, 15 Август 2025, 04:41 |
Уласцівасці рэчываў у цвёрдым агрэгатным стане вызначаюцца не толькі саставам атамаў, іонаў, малекул, але і іх узаемным размяшчэннем.
Размяшчэнне структурных адзінак можа быць упарадкаваным і неўпарадкаваным. У адпаведнасці з гэтым цвёрдыя рэчывы бываюць у крышталічным і аморфным станах.
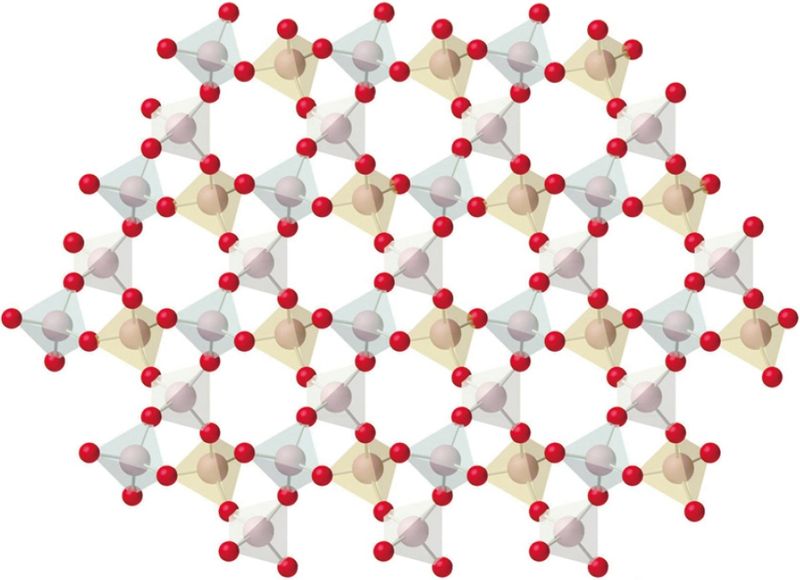
Крышталі — гэта цвёрдыя рэчывы са спарадкаваным размяшчэннем структурных адзінак (атамаў, іонаў, малекул). Крышталі маюць натуральную форму шматграннікаў, размяшчэнне структурных адзінак сіметрычна і шматразова паўтараецца (мал. 35).
Структурныя адзінкі рэчываў малекулярнай будовы — гэта малекулы. Напрыклад, структурнай адзінкай вады з’яўляецца малекула саставу Н2О, якая можа быць у цвёрдым, вадкім і газападобным станах. Аднак толькі ў крышталёў лёду малекулы вады размешчаны ўпарадкавана, гэта значыць на канкрэтнай адлегласці, пад вызначаным вуглом, утвараючы рэгулярную крышталічную структуру.
У рэчывах немалекулярнай будовы драбнюткія структурныя адзінкі — гэта атамы або іоны. Да такіх рэчываў адносяцца металы (Na, Cu, Fe) і неметалы (B і Si, алмаз і графіт, чырвоны фосфар), злучэнні металаў з неметаламі (NaCl, NaH, Na2SO4, CuCl2, Fe2O3) і неметалаў з неметаламі (SiC, SiO2).
У аморфным стане ўпарадкаванасць у размяшчэнні структурных адзінак адсутнічае. У аморфным стане знаходзяцца, напрыклад, шкло, смала, парафін, поліэтылен, сажа.
Будова, уласцівасці і спосабы атрымання крышталічных рэчываў вывучае крышталяхімія. Кожнаму крышталічнаму рэчыву ўласціва свая крышталічная структура і адпаведная ёй форма крышталёў (мал. 36). Крышталі галіту (NaCl) маюць форму куба, крышталі кварцу (SiO2) — шасціграннай прызмы.

Будову малекул паказваюць з дапамогай структурных формул, а прасторавае размяшчэнне атамаў, іонаў, малекул у крышталях адлюстроўваюць з дапамогай крышталічнай рашоткі.
Калі злучыць часціцы, якія складаюць крышталь, умоўнымі лініямі, то атрымаецца прасторавы каркас, так званая крышталічная рашотка. Кропкі перасячэння такіх ліній называюць вузламі крышталічнай рашоткі. Становішча вузлоў рашоткі мадэлюе размяшчэнне структурных адзінак крышталя — атамаў, іонаў або малекул.
Хімічная сувязь у крышталях
У табліцы 13 абагульнены асноўныя характарыстыкі крышталічных рэчываў з розным тыпам хімічнай сувязі.
Табліца 13. Тыпы крышталёў і іх уласцівасці
| Структурныя адзінкі, уласцівасці | Тыпы крышталёў, структурныя адзінкі | |||
| Атамныя | Іонныя | Металічныя | Малекулярныя | |
| Атамы неметалаў | Іоны | Атамы металаў | Малекулы | |
| Тып сувязі і яе трываласць | Кавалентная, трывалая | Іонная, трывалая | Металічная, трываласць у шырокім дыяпазоне | Слабое міжмалекулярнае ўзаемадзеянне |
| Электра- і цеплаправоднасць | Ад дыэлектрыкаў да паўправаднікоў | Ток праводзяць растворы і расплавы | Добрая электра- і цеплаправоднасць | Нізкая цеплаправоднасць, як правіла, дыэлектрыкі |
| Пластычнасць | Крохкія | Крохкія | У асноўным пластычныя (коўкія) | Неарганічныя рэчывы, як правіла, крохкія |
| Цвёрдасць | Высокая | Высокая | Змяняецца ў шырокіх межах | Як правіла, нізкая, выключэнне — фулерыт |
| Тэмпературы плаўлення і кіпення | Вельмі высокія | Ад сярэдніх да высокіх | Вялікі дыяпазон | Нізкія |
| Растваральнасць | Нерастваральныя | Могуць растварацца ў вадзе і іншых палярных растваральніках | Нерастваральныя або могуць узаемадзейнічаць з вадой | Могуць растварацца ў палярных або непалярных растваральніках |
| Прыклады рэчываў | Алмаз, графіт, крэмній, SiO2, SiС | Аксіды, гідраксіды і солі шчолачных і шчолачназямельных металаў | Металы, металічныя сплавы | Кіслоты, аксіды неметалаў (акрамя крэмнію), неметалы (напрыклад, P4, S8, I2), арганічныя рэчывы |
Адрозніваюць атамныя (кавалентная сувязь), іонныя (іонная сувязь), металічныя (металічная сувязь) і малекулярныя крышталі. Малекулярныя крышталі пабудаваны з асобных малекул, унутры якіх атамы злучаны кавалентнымі сувязямі, а паміж малекуламі дзейнічаюць больш слабыя міжмалекулярныя сілы. Малекулярныя крышталі ўтвараюць вядомыя вам цукар, аспірын, дыаксід вугляроду («сухі лёд»), вада (лёд) (мал. 37).
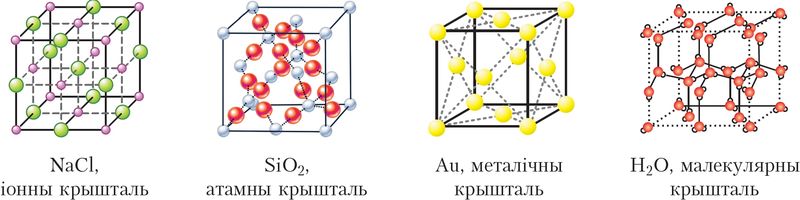
Залежнасць уласцівасцей рэчываў ад тыпу крышталічнай структуры
Уласцівасці цвёрдых рэчываў залежаць ад будовы крышталёў і трываласці хімічных сувязей у іх. Напрыклад, вуглярод утварае некалькі разнавіднасцей крышталічных структур. Адна з іх — структура алмазу, у якой кожны атам вугляроду ўтварае чатыры роўныя па трываласці кавалентныя сувязі з чатырма суседнімі атамамі вугляроду, размешчанымі ў вяршынях тэтраэдра (мал. 38). Дзякуючы сваёй будове алмаз — самае цвёрдае прыроднае рэчыва (Дадатак 2). Аналагічныя крышталічныя структуры і блізкую да алмаза цвёрдасць маюць карбарунд SiC і боразон BN.
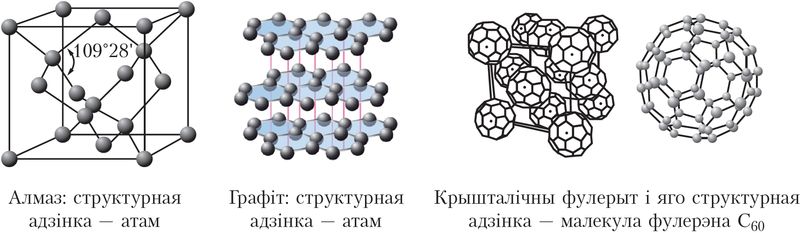
Другая разнавіднасць крышталічнага вугляроду — графіт. У графіце атамы вугляроду размешчаны слаямі. У слаях кожны атам вугляроду выкарыстоўвае тры свае электроны для ўтварэння трох кавалентных сувязей з суседнімі атамамі. Чацвёрты электрон удзельнічае ва ўтварэнні дылакалізаваных π-сувязей і можа свабодна перамяшчацца ўздоўж слоя. Таму графіт валодае электраправоднасцю і выкарыстоўваецца для вырабу электракантактаў, змазак, што праводзяць ток, электродаў і інш.
Адлегласць паміж слаямі графіту значна большая, чым паміж атамамі ў слоі, таму графіт лёгка расслойваецца. Дзякуючы гэтай уласцівасці з графіту вырабляюць грыфель алоўкаў, ён уваходзіць у састаў розных змазак, якія зніжаюць трэнне, і сам з’яўляецца цвёрдай змазкай у формах для ліцця металаў.
Трэцяя крышталічная мадыфікацыя вугляроду — фулерыт — утворана малекуламі фулерэну С60, якія складаюцца з 60 атамаў вугляроду.
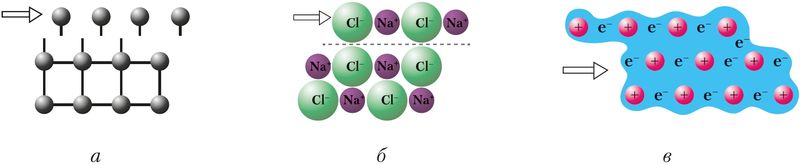
Атамныя, іонныя і металічныя крышталі адрозніваюцца ўстойлівасцю да механічнай дэфармацыі, у выніку якой адбываецца зрушванне асобных слаёў крышталічнай структуры (мал. 39). Пры гэтым счапленне паміж слаямі ў атамных крышталях (а) парушаецца з-за разрыву хімічных сувезей паміж атамамі, а ў іонных — з-за адштурхоўвання аднайменна зараджаных іонаў (б). У металічных крышталях дзякуючы асаблівасцям металічнай сувязі крышталі не разбураюцца, а дэфармуюцца. Таму металы пластычныя (коўкія), а атамныя і іонныя крышталі — крохкія.
Крышталі — гэта цвёрдыя рэчывы з упарадкаваным размяшчэннем структурных адзінак (атамаў, іонаў, малекул).
У залежнасці ад будовы вылучаюць чатыры тыпы крышталёў: атамныя, іонныя, малекулярныя і металічныя. Яны адрозніваюцца сваімі ўласцівасцямі.
Пытанні, заданні, задачы
1. У чым заключаюцца асноўныя адрозненні рэчываў малекулярнай і немалекулярнай будовы? Прывядзіце прыклады.
2. Параўнайце ўласцівасці атамных, малекулярных, іонных і металічных крышталёў.
3. Растлумачце, чаму іонныя і малекулярныя крышталі практычна не праводзяць электрычны ток. Чым абумоўлена добрая электра- і цеплаправоднасць металічных крышталёў?
4. Ці могуць праводзіць ток рэчывы:
- а) з іоннай сувяззю;
- б) з кавалентнай сувяззю?
Прывядзіце прыклады і ўмовы праяўлення гэтымі рэчывамі электраправоднасці.
5. Вызначце тыпы хімічнай сувязі і тыпы крышталёў рэчываў, формулы якіх: SO2, SiС, CsF, K2SO4, Cu6Sn5.
6. Канструктару спатрэбілася вельмі цвёрдае рэчыва, устойлівае да дзеяння высокіх тэмператур і растваральнікаў. Якое са злучэнняў, пералічаных у задачы 5, ён можа выкарыстаць у сваіх выпрабаваннях?
7. Растлумачце, чаму графіт валодае электраправоднасцю, а алмаз — не.
8. Сплаў Розэ (Tпл. +94 °C) выкарыстоўваецца ў плаўкіх электрычных засцерагальніках, а таксама ў радыётэхніцы ў якасці прыпою. Састаў сплаву (па масе): свінец (25 %), вісмут (50 %), волава (25 %). Пакажыце тып яго крышталёў. Разлічыце масу кожнага кампанента, неабходнага для атрымання сплаву масай 5 кг.
9. Разлічыце мольныя суадносіны кампанентаў у сплаве Вуда. Сплаў Вуда — цяжкі легкаплаўкі сплаў, які стварыў у 1860 годзе амерыканскі дантыст Вуд. Тэмпература плаўлення — 68,5 °C. Састаў (масавыя долі): волаву — 12,5 %, свінцу — 25 %, вісмуту — 50 %, кадмію — 12,5 %. Якімі іншымі фізічнымі ўласцівасцямі можа, на вашу думку, валодаць гэты сплаў?
10. Вызначце лік атамаў у порцыі масай 1 г аднаго з самых цвёрдых сінтэтычных рэчываў, які ўяўляе сабой бінарнае злучэнне бору і азоту BN.
*Самакантроль
1. Вылучаюць тыпы крышталёў:
- а) атамныя;
- б) іонныя;
- в) кавалентныя;
- г) малекулярныя.
2. Іонныя крышталі мае рэчыва саставу:
- а) KBr;
- б) H2S;
- в) C6H5OH;
- г) SiO2.
3. Атамныя крышталі ўтвараюць:
- а) KСl;
- б) Na2SO4;
- в) SiO2;
- г) SiС.
4. Малекулярныя крышталі ўтвараюць:
- а) Сs2S;
- б) Н2;
- в) РН3;
- г) HCl.
5. Пластычным і крохкім адпаведна з’яўляюцца рэчывы ў пары:
- а) NаCl і S8;
- б) Au і Сu;
- в) KCl і Fe;
- г) Al і NH4NO3.