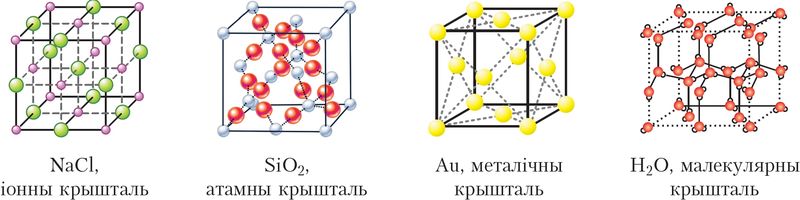
§ 16. Тыпы крышталічных структур
Хімічная сувязь у крышталях
У табліцы 13 абагульнены асноўныя характарыстыкі крышталічных рэчываў з розным тыпам хімічнай сувязі.
Табліца 13. Тыпы крышталёў і іх уласцівасці
| Структурныя адзінкі, уласцівасці | Тыпы крышталёў, структурныя адзінкі | |||
| Атамныя | Іонныя | Металічныя | Малекулярныя | |
| Атамы неметалаў | Іоны | Атамы металаў | Малекулы | |
| Тып сувязі і яе трываласць | Кавалентная, трывалая | Іонная, трывалая | Металічная, трываласць у шырокім дыяпазоне | Слабое міжмалекулярнае ўзаемадзеянне |
| Электра- і цеплаправоднасць | Ад дыэлектрыкаў да паўправаднікоў | Ток праводзяць растворы і расплавы | Добрая электра- і цеплаправоднасць | Нізкая цеплаправоднасць, як правіла, дыэлектрыкі |
| Пластычнасць | Крохкія | Крохкія | У асноўным пластычныя (коўкія) | Неарганічныя рэчывы, як правіла, крохкія |
| Цвёрдасць | Высокая | Высокая | Змяняецца ў шырокіх межах | Як правіла, нізкая, выключэнне — фулерыт |
| Тэмпературы плаўлення і кіпення | Вельмі высокія | Ад сярэдніх да высокіх | Вялікі дыяпазон | Нізкія |
| Растваральнасць | Нерастваральныя | Могуць растварацца ў вадзе і іншых палярных растваральніках | Нерастваральныя або могуць узаемадзейнічаць з вадой | Могуць растварацца ў палярных або непалярных растваральніках |
| Прыклады рэчываў | Алмаз, графіт, крэмній, SiO2, SiС | Аксіды, гідраксіды і солі шчолачных і шчолачназямельных металаў | Металы, металічныя сплавы | Кіслоты, аксіды неметалаў (акрамя крэмнію), неметалы (напрыклад, P4, S8, I2), арганічныя рэчывы |
Адрозніваюць атамныя (кавалентная сувязь), іонныя (іонная сувязь), металічныя (металічная сувязь) і малекулярныя крышталі. Малекулярныя крышталі пабудаваны з асобных малекул, унутры якіх атамы злучаны кавалентнымі сувязямі, а паміж малекуламі дзейнічаюць больш слабыя міжмалекулярныя сілы. Малекулярныя крышталі ўтвараюць вядомыя вам цукар, аспірын, дыаксід вугляроду («сухі лёд»), вада (лёд) (мал. 37).