§ 14. Уласцівасці хімічных сувязей
Пытанні, заданні, задачы
1. Апішыце, як утвараецца:
- а) трайная сувязь у малекуле азоту;
- б) двайная сувязь у малекуле кіслароду.
2. Запоўніце табліцу, паставіўшы ў ячэйкі пад кожнай хімічнай сувяззю адпаведнае значэнне энергіі (167; 945; 418 кДж/моль) і даўжыні сувязі (0,145; 0,110; 0,125 нм). Растлумачце свой выбар.
| Сувязь | |||
| Энергія, кДж/моль | |||
| Даўжыня, нм |
3. Укажыце лік адзінарных і кратных сувязей у кожнай малекуле:
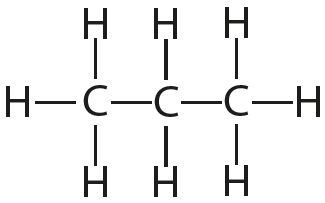
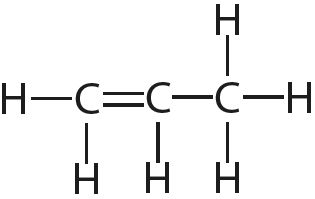
4. Адзначце палярныя і непалярныя кавалентныя сувязі:
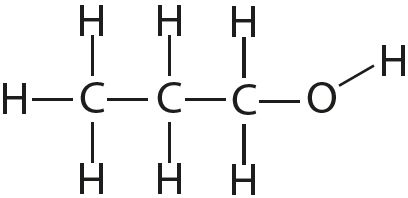
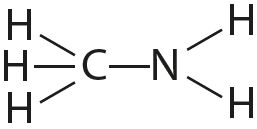
5. Растлумачце, чаму і як змяняецца даўжыня сувязі паміж атамамі ў радзе
- а) вугляроду:
,
,
;
- б) азоту:
,
.
6. Супастаўце даўжыню і энергію сувязі паміж атамамі вугляроду і кіслароду ў радзе:
метанол , метаналь
, чадны газ
![]() .
.
7. Растлумачце памяншэнне тэрмічнай устойлівасці злучэнняў у радзе: Н2О, Н2S, Н2Se.
8. Растлумачце, чаму малекулы вадароду і фтору ўступаюць ва ўзаемадзеянне імгненна, а для ўзаемадзеяння малекул вадароду і азоту неабходны высокія тэмпература і ціск.
9. Намалюйце схему перакрывання атамных 1s- і 3p-арбіталей у малекуле H2X, калі адносная шчыльнасць гэтага газападобнага злучэння па вадародзе DН2 роўная 17.
10. Энергія сувязі ў малекуле O2 роўная 494 кДж/моль. Якую энергію трэба выдаткаваць, каб разарваць усе сувязі ва ўзоры кіслароду аб’ёмам 1 дм3 (н. у.)?