§ 14. Уласцівасці хімічных сувязей
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 14. Уласцівасці хімічных сувязей |
| Напечатано:: | Гость |
| Дата: | Среда, 13 Август 2025, 04:33 |
Уласцівасці рэчываў вызначаюцца не толькі іх элементным саставам, але і асаблівасцямі хімічных сувязей паміж атамамі.
Уласцівасці кавалентнай сувязі
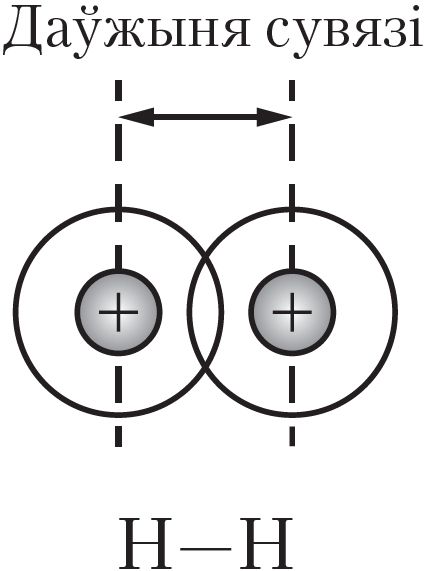
Кавалентная сувязь характарызуецца даўжынёй, энергіей, кратнасцю, насычальнасцю, скіраванасцю і палярнасцю.
Даўжыня кавалентнай сувязі — гэта адлегласць паміж ядрамі хімічна звязаных атамаў (мал. 27). Даўжыня кавалентнай сувязі звычайна крыху адрозніваецца ад сумы атамных радыусаў з-за пераразмеркавання электроннай шчыльнасці і перакрывання электронных воблакаў (мал. 27–29). Чым большыя радыусы звязаных атамаў, тым большая даўжыня сувязі (табл. 12).
Табліца 12. Характарыстыка кавалентных сувязей у малекулах вадароду і галагенавадародаў
| Элемент | Радыус атама, нм | Малекула | Даўжыня сувязі, нм | Eсувязі, кДж/моль | Δχ | Мадэль малекулы |
| Н | 0,037 | H2 | 0,074 | 436 | 0 | |
| F | 0,071 | HF | 0,092 | 565 | 1,8 | |
| Cl | 0,099 | HCl | 0,128 | 431 | 0,8 | |
| Br | 0,114 | HBr | 0,141 | 364 | 0,6 | |
| I | 0,133 | HI | 0,161 | 297 | 298 |
Энергія хімічнай сувязі (Eсувязі) — гэта энергія, якую неабходна затраціць на яе разрыў. Як правіла, чым больш трывалая сувязь, тым меншая яе даўжыня (табл. 12).
Кратнасцю кавалентнай сувязі называюць колькасць электронных пар, якія ўдзельнічаюць ва ўтварэнні хімічнай сувязі паміж двума атамамі.
Адрозніваюць адзінарныя (), двайныя (
) і трайныя (
) сувязі.
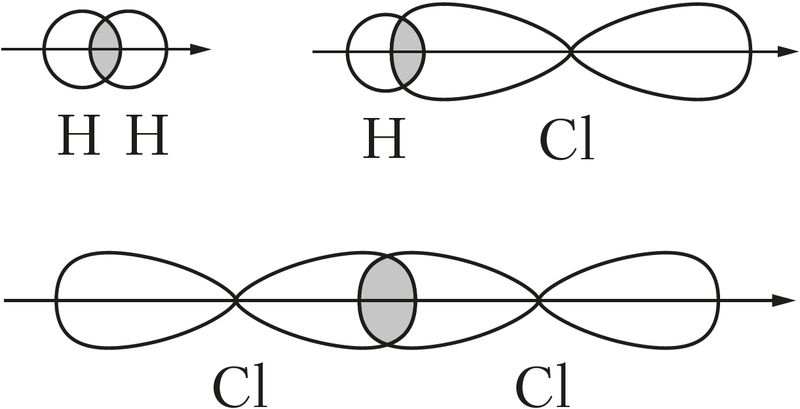
Пры перакрыванні арбіталей уздоўж лініі, якая злучае ядры атамаў, утвараюцца толькі σ-сувязі (мал. 28).
Але дзве ці тры кавалентныя сувязі паміж двума атамамі не могуць адначасова ўтварацца ў адной плоскасці. Таму ў выпадку двайных і трайных сувязей адбываецца «бакавое» перакрыванне р- або d-арбіталей, гэта значыць утвараюцца π-сувязі:
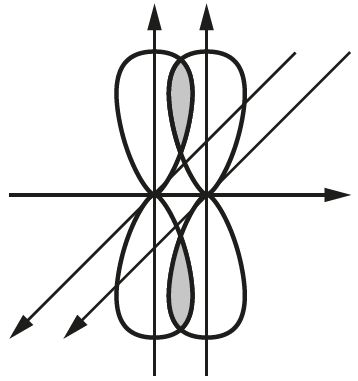
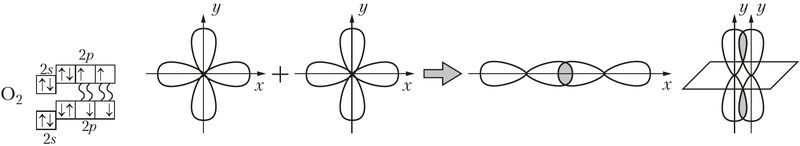
Напрыклад, двайная сувязь у малекуле кіслароду ![]() ўтвараецца пры перакрыванні дзвюх р-арбіталей. Пры гэтым перпендыкулярна размешчаныя р-арбіталі ўтвараюць адну σ- і адну π-сувязі (мал. 29).
ўтвараецца пры перакрыванні дзвюх р-арбіталей. Пры гэтым перпендыкулярна размешчаныя р-арбіталі ўтвараюць адну σ- і адну π-сувязі (мал. 29).
Трайная сувязь у малекуле азоту ![]() узнікае пры перакрыванні трох р-арбіталей. Пры гэтым утвараецца адна σ-сувязь і дзве π-сувязі, як паказана на малюнку 30.
узнікае пры перакрыванні трох р-арбіталей. Пры гэтым утвараецца адна σ-сувязь і дзве π-сувязі, як паказана на малюнку 30.
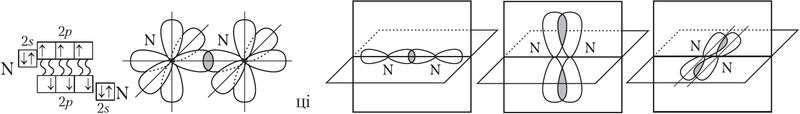
Кратнасць сувязі наглядна ўказваюць у структурных формулах. Так, у малекуле фармальдэгіду дзве адзінарныя і адна двайная сувязь: ![]() . Пры гэтым у ёй тры σ-сувязі і адна π-сувязь.
. Пры гэтым у ёй тры σ-сувязі і адна π-сувязь.
Накіраванасць кавалентных сувязей вызначаецца арыентацыяй у прасторы атамных арбіталей, якія ўдзельнічаюць ва ўтварэнні сувязі. Яна абумоўлівае прасторавую структуру малекул (мал. 31).
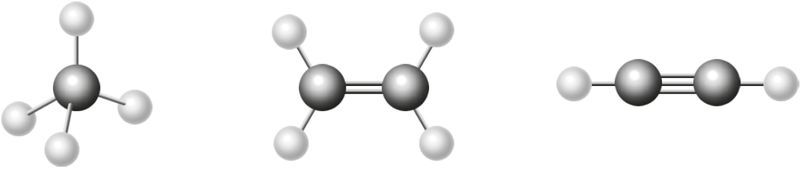
Вугал, утвораны напрамкамі хімічных сувязей, якія выходзяць з аднаго атама, называюць валентным вуглом.
Напрыклад, вам вядома, што ў малекуле CH4 сувязі знаходзяцца пад вуглом прыблізна 109°, у малекуле — 120°, у малекуле
— 180°.
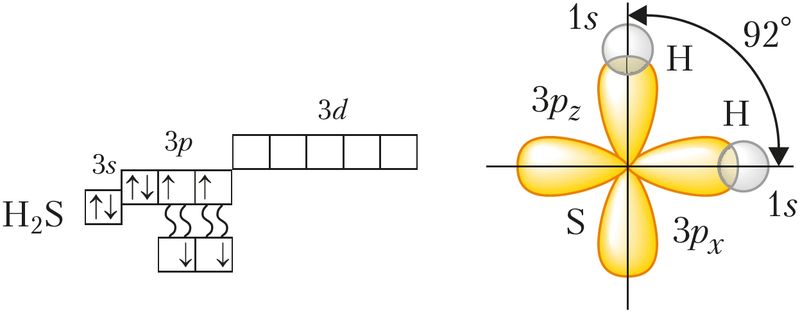
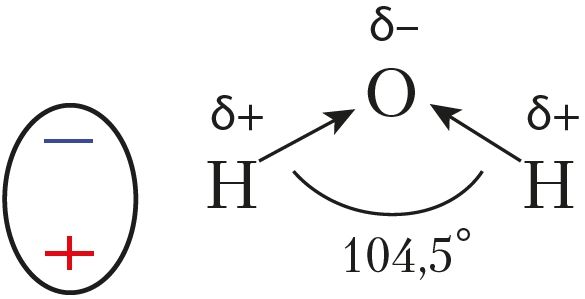
У малекулах Н2О і Н2S атамы кіслароду і серы ўтвараюць дзве σ-сувязі з атамамі вадароду. Ва ўтварэнні гэтых сувязей удзельнічаюць p-арбіталі знешняга энергетычнага ўзроўню, якія арыентаваны ўзаемна перпендыкулярна. Гэта значыць, што валентныя вуглы паміж лініямі сувязі О—Н або S—H павінны быць блізкія да 90°. Аднак рэальныя значэнні гэтых вуглоў крыху большыя з-за ўзаемнага адштурхоўвання атамаў вадароду (мал. 32). Так, у малекуле вады, якая знаходзіцца ў пары, гэты вугал роўны 104,5°, а ў малекуле Н2S — 92° (адштурхоўванне слабейшае з-за большага радыуса атама серы).
Аналагічна: у малекулах NH3 тры ўзаемна перпендыкулярныя р-арбіталі атама азоту ўтвараюць тры σ-сувязі з атамамі вадароду і валентныя вуглы павінны быць роўнымі 90°. Узаемнае адштурхоўванне атамаў вадароду прыводзіць да павелічэння гэтых вуглоў да 107°. Больш падрабязна гэты матэрыял разгледжаны ў § 37.
Для прагназавання і тлумачэння велічыні валентных вуглоў у многіх малекулах часта выкарыстоўваюць ўяўленні аб гібрыдызацыі атамных арбіталей. Пачатковыя ўяўленні аб гібрыдызацыі вы атрымалі ў курсе арганічнай хіміі ў 10-м класе. З улікам гібрыдызацыі можна растлумачыць будову малекул СН4, NH3, H2O. Пры гібрыдызацыі атамных арбіталей атама, які ўтварае сувязі з суседнімі атамамі, адбываецца асярэдненне па форме і энергіі электроннай шчыльнасці блізкіх па энергіі арбіталей. Напрыклад, пры асярэдненні энергіі адной s-арбіталі і трох р-арбіталей дадзенага атама вугляроду ўтвараюцца чатыры аднолькавыя гібрыдныя арбіталі, якія размяшчаюцца ў кірунку да вяршынь тэтраэдра:
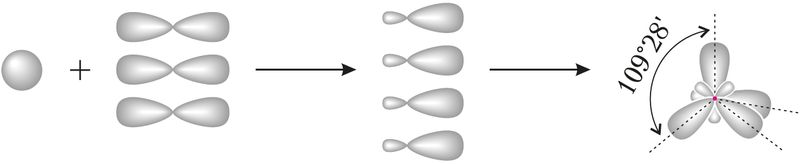
Тэтраэдрычная будова малекулы метану тлумачыцца sp3-гібрыдызацыяй атамных арбіталей вугляроду.
Палярнасць сувязі — характарыстыка, якая ўлічвае зрушванне агульнай электроннай пары да аднаго з атамаў. Калі кавалентная сувязь утворана атамамі з аднолькавай электраадмоўнасцю, сувязь адносяць да непалярнай (H2, Cl2, N2). У выпадку рознай электраадмоўнасці сувязь будзе палярная (НСl, NH3). Чым большая рознасць значэнняў электраадмоўнасці (Δχ) у звязаных атамаў, тым большая палярнасць кавалентнай сувязі. Напрыклад, сувязь у малекуле H—Cl больш палярная, чым у малекуле H—Br, паколькі электраадмоўнасць атама Cl (3,0) большая, чым у Br (2,8). На атамах узнікае частковы (няцэлалікавы) зарад. Яго абазначаюць знакамі δ+, δ–.
Зрушванне электроннай шчыльнасці ўказваюць у структурных формулах стрэлкамі, накіраванымі ў бок больш электраадмоўнага атама. Зрушванне электроннай шчыльнасці пры ўтварэнні σ-сувязі паказваюць прамой стрэлкай, а π-сувязі — дугой:
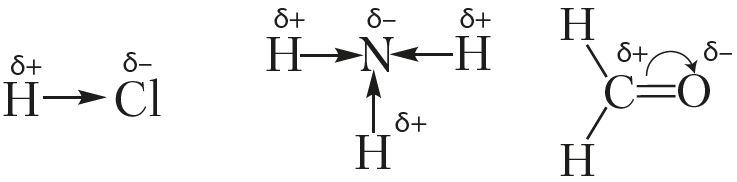
Малекулу, электронная будова якой апісваецца як сістэма з двух роўных па абсалютнай велічыні, але процілеглых па знаку зарадаў, размешчаных на вызначанай адлегласці адзін ад аднаго, называюць дыполем.
Малекулы, якія ўяўляюць сабой дыполі, называюць палярнымі. Палярнымі з’яўляюцца малекулы галагенавадародаў, серавадароду, вады. Так, у малекуле вады электронная шчыльнасць зрушана ад атамаў вадароду да больш электраадмоўнага атама кіслароду. Малекулы вады — гэта дыполі (мал. 33).
Насычальнасцю называюць здольнасць атама ўтвараць пэўны лік кавалентных сувязей. Гэты лік сувязей вызначаецца валентнасцю атама. Любы атам абмежаваны ў сваіх магчымасцях утвараць кавалентныя сувязі. Іх не можа быць больш, чым лік атамных арбіталей, якія могуць прыняць удзел ва ўтварэнні кавалентных сувязей. Для элементаў 2-га перыяду такіх сувязей не можа быць больш за чатыры, бо на знешнім электронным слоі атамаў гэтых элементаў маецца толькі чатыры арбіталі. У элементаў 3-га перыяду насычальнасць павышаецца за кошт вакантных d-арбіталей.
Уласцівасці іоннай і металічнай сувязей
Даўжыня і энергія іонных сувязей залежаць ад памеру і зараду іонаў, якія ўзаемадзейнічаюць. Як правіла, чым меншы памер і большы зарад іонаў, тым больш трывалая сувязь. Значэнні яе энергіі знаходзяцца ў межах 300–700 кДж/моль.
У адрозненне ад кавалентнай сувязі іонная сувязь ненакіраваная і ненасычальная, паколькі іон можа прыцягваць да сябе іоны процілеглага знака ў любым кірунку. Размяшчэнне і лік суседніх іонаў вызначаецца іх памерамі, сіламі прыцяжэння і адштурхоўвання паміж іонамі розных знакаў. Таму іоны размяшчаюцца ў вызначаным парадку, утвараючы крышталічную рашотку.
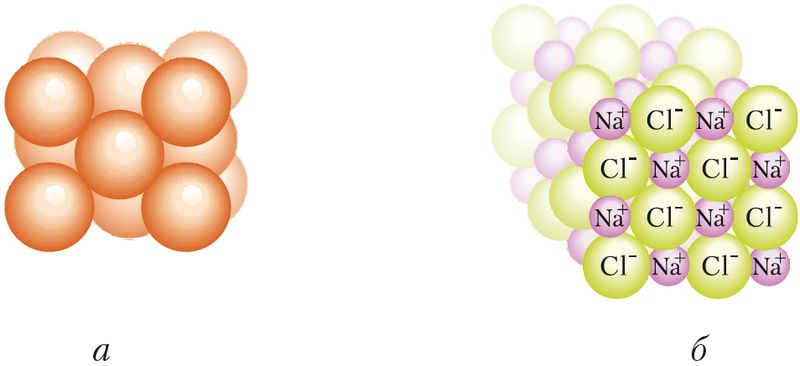
Металічная сувязь таксама ненакіраваная і ненасычальная. Яе энергія змяняецца ў шырокіх межах: ад дзясяткаў да некалькіх сотняў кДж/моль. У крышталях металаў атамы маюць вялікую колькасць найбліжэйшых суседзяў, што забяспечвае вельмі шчыльную ўпакоўку атамаў. Так, у крышталях у атама медзі 12 найбліжэйшых суседзяў, а ў іона натрыю ў NaCl — шэсць суседніх іонаў Cl–. Будову крышталёў можна паказаць у выглядзе шчыльна спакаваных шароў (мал. 34).
Кавалентная сувязь характарызуецца даўжынёй, энергіяй, кратнасцю, накіраванасцю і палярнасцю:
- • даўжыня — адлегласць паміж ядрамі хімічна звязаных атамаў;
- • энергія сувязі — энергія, якую неабходна выдаткаваць на яе разрыў;
- • кратнасць — лік электронных пар, якія ўдзельнічаюць ва ўтварэнні сувязі;
- • накіраванасць кавалентных сувязей вызначаецца арыентацыяй у прасторы атамных арбіталей, якія ўдзельнічаюць ва ўтварэнні сувязі;
- • палярнасць сувязі вызначаецца ступенню зрушвання агульнай электроннай пары да аднаго з атамаў;
- • насычальнасць — здольнасць атама ўтвараць пэўны лік кавалентных σ-сувязей.
Іонная і металічная сувязі ненакіраваныя і ненасычальныя.
Пытанні, заданні, задачы
1. Апішыце, як утвараецца:
- а) трайная сувязь у малекуле азоту;
- б) двайная сувязь у малекуле кіслароду.
2. Запоўніце табліцу, паставіўшы ў ячэйкі пад кожнай хімічнай сувяззю адпаведнае значэнне энергіі (167; 945; 418 кДж/моль) і даўжыні сувязі (0,145; 0,110; 0,125 нм). Растлумачце свой выбар.
| Сувязь | |||
| Энергія, кДж/моль | |||
| Даўжыня, нм |
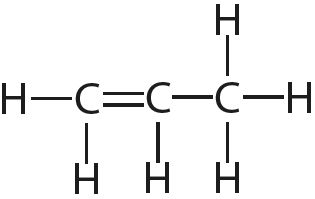
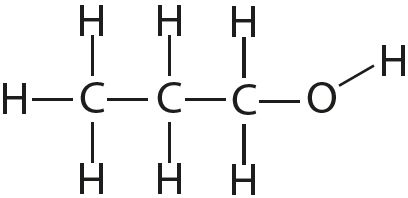
3. Укажыце лік адзінарных і кратных сувязей у кожнай малекуле:
4. Адзначце палярныя і непалярныя кавалентныя сувязі:
5. Растлумачце, чаму і як змяняецца даўжыня сувязі паміж атамамі ў радзе
- а) вугляроду:
,
,
;
- б) азоту:
,
.
6. Супастаўце даўжыню і энергію сувязі паміж атамамі вугляроду і кіслароду ў радзе:
метанол , метаналь
, чадны газ
![]() .
.
7. Растлумачце памяншэнне тэрмічнай устойлівасці злучэнняў у радзе: Н2О, Н2S, Н2Se.
8. Растлумачце, чаму малекулы вадароду і фтору ўступаюць ва ўзаемадзеянне імгненна, а для ўзаемадзеяння малекул вадароду і азоту неабходны высокія тэмпература і ціск.
9. Намалюйце схему перакрывання атамных 1s- і 3p-арбіталей у малекуле H2X, калі адносная шчыльнасць гэтага газападобнага злучэння па вадародзе DН2 роўная 17.
10. Энергія сувязі ў малекуле O2 роўная 494 кДж/моль. Якую энергію трэба выдаткаваць, каб разарваць усе сувязі ва ўзоры кіслароду аб’ёмам 1 дм3 (н. у.)?
*Самакантроль
1. Накіраванасцю і насычальнасцю характарызуецца сувязь:
- а) кавалентная непалярная;
- б) іонная;
- в) металічная;
- г) кавалентная палярная.
2. Дзве злучальныя і дзве незлучальныя электронныя пары ўтрымліваюць малекулы:
3. σ-Сувязі адпавядае перакрыванне арбіталей:
4. Даўжыня сувязі ў першай малекуле большая, чым у другой, у пары рэчываў:
- а) HCl і HBr;
- б) H2S і H2O;
- в) NH3 і PH3;
- г) NCl3 і PCl3.
5. Энергія сувязі памяншаецца ў радах:
- а) HCl, HBr, HI;
- б)
,
,
;
- в) I2, Br2, Cl2;
- г) N2, O2, I2.