§ 14. Уласцівасці хімічных сувязей
Уласцівасці іоннай і металічнай сувязей
Даўжыня і энергія іонных сувязей залежаць ад памеру і зараду іонаў, якія ўзаемадзейнічаюць. Як правіла, чым меншы памер і большы зарад іонаў, тым больш трывалая сувязь. Значэнні яе энергіі знаходзяцца ў межах 300–700 кДж/моль.
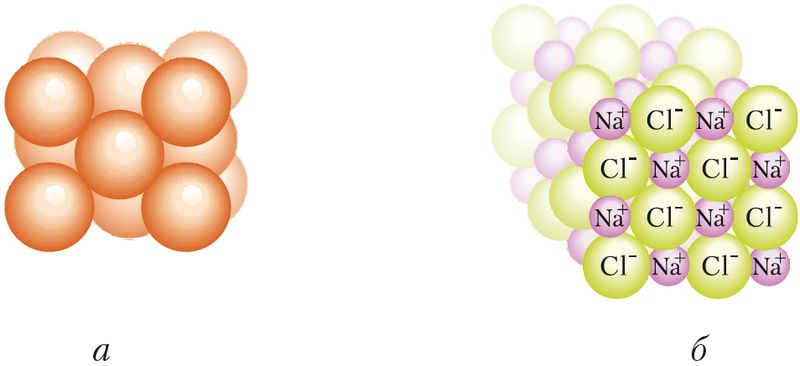
У адрозненне ад кавалентнай сувязі іонная сувязь ненакіраваная і ненасычальная, паколькі іон можа прыцягваць да сябе іоны процілеглага знака ў любым кірунку. Размяшчэнне і лік суседніх іонаў вызначаецца іх памерамі, сіламі прыцяжэння і адштурхоўвання паміж іонамі розных знакаў. Таму іоны размяшчаюцца ў вызначаным парадку, утвараючы крышталічную рашотку.
Металічная сувязь таксама ненакіраваная і ненасычальная. Яе энергія змяняецца ў шырокіх межах: ад дзясяткаў да некалькіх сотняў кДж/моль. У крышталях металаў атамы маюць вялікую колькасць найбліжэйшых суседзяў, што забяспечвае вельмі шчыльную ўпакоўку атамаў. Так, у крышталях у атама медзі 12 найбліжэйшых суседзяў, а ў іона натрыю ў NaCl — шэсць суседніх іонаў Cl–. Будову крышталёў можна паказаць у выглядзе шчыльна спакаваных шароў (мал. 34).