§ 13. Прырода і тыпы хімічнай сувязі
Пытанні, заданні, задачы
1. Вызначце тып хімічнай сувязі, прадстаўлены электроннымі схемамі:
| а) | в) | ||
| б) | г) |
2. Складзіце электронныя формулы малекул вадароду, хлору, хлоравадароду, вады, аміяку і ўкажыце лік звязаных і непадзеленых электронных пар у кожнай з іх.
3. Укажыце тып хімічнай сувязі паміж атамамі ў наступных злучэннях:
- а) СaCl2, BaO, S8, CaF2, CCl4, сплаў Fe—C;
- б) I2, SiO2, Na2S, О3, C2H5OH, сплаў Au—Cu.
4. Параўнайце электронныя схемы і электронныя канфігурацыі:
- а) атама Li і іона Li+ у брамідзе літыю;
- б) атама Сl і іона Сl– у хларыдзе калію;
- в) атама S і атама серы ў малекуле серавадароду.
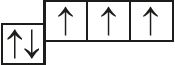
5. Назавіце механізм утварэння сувязі паміж атамамі, якія маюць наступныя электронна-графічныя схемы знешніх электронных абалонак:
- а)
и
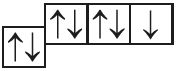
- б)
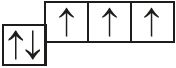 и
и 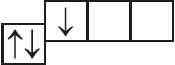
- в)
и
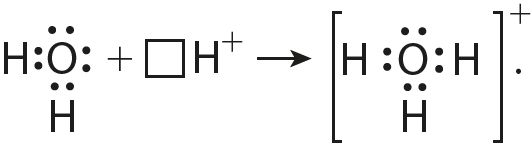
6. Згодна з прыведзенай схемай растлумачце механізм утварэння кавалентнай сувязі ў іоне гідраксонію пры ўзаемадзеянні малекулы вады і іона вадароду:
7. Выкарыстоўваючы значэнні электраадмоўнасці элементаў (табл. 7), абгрунтуйце тып хімічнай сувязі ў рэчывах і часціцах: ,
,
,
,
,
.
| Хімічная формула рэчыва або часціцы | Электраадмоўнасць атамаў | Рознасць электраадмоўнасцей ∆χ |
Тып хімічнай сувязі | |
| χ1 | χ2 | |||
8. Укажыце злучэнні, якія маюць як кавалентную, так і іонную сувязь: НСООН, CH3COONa, MgF2, MgSO4, NH4NO3, HNO3, KNO3, CaSO4, NH3.
9. Вызначце лік электронаў, якія ўдзельнічаюць ва ўтварэнні кавалентных сувязей у іонах амонію колькасцю 3 моль.
10. Пры ўтварэнні метану з атамаў вугляроду і вадароду вылучаецца 1662 кДж/моль энергіі. Вылічыце сярэднюю энергію сувязі С—Н (кДж/моль).