§ 13. Прырода і тыпы хімічнай сувязі
| Site: | Профильное обучение |
| Course: | Хімія. 11 клас |
| Book: | § 13. Прырода і тыпы хімічнай сувязі |
| Printed by: | Guest user |
| Date: | Wednesday, 13 August 2025, 8:43 PM |
Любое хімічнае злучэнне — малекулу (CO2), крышталь (NaCl), складаны іон () — з пункту гледжання электроннай будовы можна ўявіць у выглядзе сістэмы, якая складаецца з атамных ядраў і электронаў, якія іх злучаюць. Узаемадзеянне, якое робіць гэтую сістэму ўстойлівай, называюць хімічнай сувяззю.
Хімічная сувязь — гэта ўзаемадзеянне, у выніку якога асобныя атамы аб’ядноўваюцца ў больш складаныя сістэмы (малекулы, крышталі, іоны і інш.).
Хімічная сувязь абумоўлена дзеяннем сіл прыцяжэння і адштурхоўвання паміж дадатна зараджанымі ядрамі і адмоўна зараджанымі электронамі, гэта значыць мае электрастатычную прыроду.
Электроны, якія прымаюць удзел ва ўтварэнні хімічных сувязей, называюць валентнымі. Гэта электроны знешніх электронных абалонак атамаў.
Разгледзім, як і чаму ўтвараецца хімічная сувязь.
Асноўнай умовай утварэння хімічнай сувязі з’яўляецца паніжэнне поўнай энергіі сістэмы ядраў і электронаў у параўнанні з энергіяй ізаляваных атамаў.
Памяншэнне поўнай энергіі сістэмы ядраў і электронаў дасягаецца ў выніку сумеснага выкарыстання электронаў рознымі атамамі. У залежнасці ад таго, як у выніку размеркавана электронная шчыльнасць, адрозніваюць тры тыпы хімічнай сувязі: кавалентную, іонную і металічную.
Механізмы ўтварэння гэтых сувязей вы ўжо разглядалі пры вывучэнні хіміі ў 8–10-х класах. Тут мы дапоўнім паняцце хімічнай сувязі ўяўленнямі аб стане электронаў у атаме.
Кавалентная сувязь
Кавалентная сувязь — гэта хімічная сувязь, утвораная агульнымі электроннымі парамі. Яе называюць лакалізаванай, паколькі агульная пара электронаў размяшчаецца (лакалізуецца) паміж двума ядрамі. Гэта прымушае дадатна зараджаныя ядры прыцягвацца да пары электронаў, размешчанай паміж ядрамі. Такая сувязь узнікае паміж атамамі з аднолькавымі або блізкімі значэннямі электраадмоўнасці. Як правіла, гэта атамы неметалаў.
З’яўленне пары электронаў, якая злучае суседнія атамы, можна паказаць двума спосабамі, гэта значыць існуе два механізмы ўтварэння кавалентнай сувязі — абменны і донарна-акцэптарны.
Абменны механізм тлумачыць утварэнне агульнай электроннай пары з няспараных валентных электронаў, якія належаць розным атамам. Пры гэтым электроны, якія ўтвараюць агульную пару, павінны мець супрацьлеглыя (антыпаралельные) спіны. Перакрыванне двух электронных воблакаў прыводзіць да павелічэння электроннай шчыльнасці паміж ядрамі:
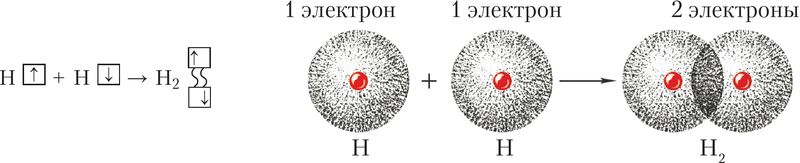
Ва ўтварэнні кавалентнай сувязі могуць удзельнічаць s-, p- і d-электронныя воблакі. Напрыклад, у злучэнні атамаў хлору і вадароду ў малекуле H—Сl удзельнічаюць 1s-электрон атама вадароду і няспараны 3p-электрон атама хлору (мал. 24).
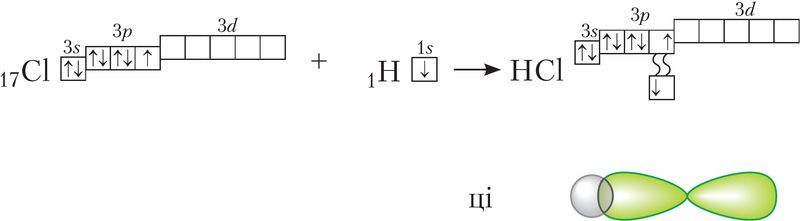
Кожны са звязаных у агульную электронную пару атамаў набывае электронную канфігурацыю высакароднага газу: вадарод — гелію 1s2, а хлор — аргону 1s22s22р63s23р6. У выніку абодва атамы дасягаюць найбольш устойлівай электроннай канфігурацыі.
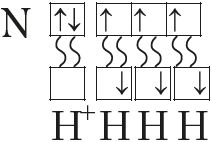
Яшчэ адзін прыклад — утварэнне сувязей у малекуле аміяку NH3. У атама азоту згодна з электронна-графічнай схемай ёсць тры няспараныя электроны 7N  , у атама вадароду — адзін
, у атама вадароду — адзін . Гэтыя электроны ўдзельнічаюць ва ўтварэнні трох кавалентных сувязей па абменным механізме з атамамі вадароду:
![]() или
или ![]()
Адзначым, што адначасова з гэтым у азоту на 2s-арбіталі застаецца непадзеленая электронная пара — пара электронаў, якая не прымае ўдзелу ва ўтварэнні хімічных сувязей.
Абменным механізмам тлумачаць утварэнне кавалентнай сувязі ў пераважнай большасці малекул арганічных і неарганічных рэчываў, у атамных крышталях алмазу C, чырвонага фосфару P, карбарунду SiC, кварцу SiO2 і інш.
Донарна-акцэптарны механізм утварэння кавалентнай сувязі прадугледжвае ўтварэнне электроннай пары за кошт перадачы непадзеленай электроннай пары ад аднаго атама (донара) на вакантную атамную арбіталь другога (акцэптара). У якасці прыкладу разгледзім утварэнне хімічнай сувязі ў катыёна амонію пры працяканні рэакцыі:
(хларыд амонію)
або ў іонным выглядзе:
(іон амонію).
Гэтае ўзаемадзеянне можна паказаць электроннымі формуламі:
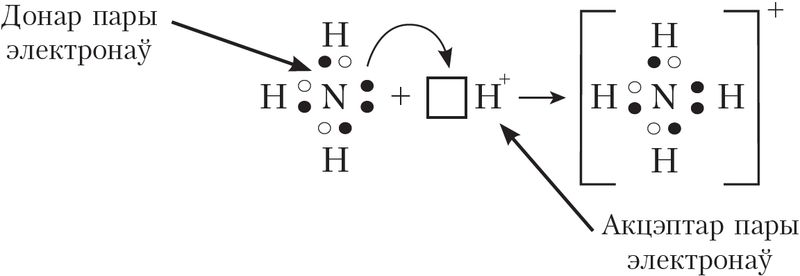
Пры ўзаемадзеянні малекулы 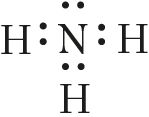 з катыёнам вадароду
з катыёнам вадароду , у якога на 1s-арбіталі няма электронаў, непадзеленая пара электронаў азоту размяшчаецца на свабоднай 1s-арбіталі
іона вадароду. У выніку ўтвараецца катыён амонію
з чатырма кавалентнымі сувязямі:
Паколькі малекула аміяку электранейтральная, а далучаны да яе іон мае зарад «+», то катыён амонію, які ўтварыўся, таксама мае дадатны зарад. Гэты зарад належыць цэламу іону, а не асобнаму атаму, таму ў структурнай формуле знак зараду іона ставяць за квадратнай дужкай: 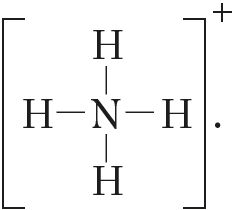 Калі мы хочам падкрэсліць механізм утварэння сувязі, то можна стрэлкай паказаць кірунак зрушвання электроннай пары ад донара да акцэптара:
Калі мы хочам падкрэсліць механізм утварэння сувязі, то можна стрэлкай паказаць кірунак зрушвання электроннай пары ад донара да акцэптара: 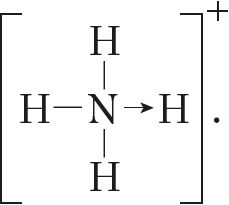 Але рабіць гэта неабавязкова, бо ўсе сувязі ў малекуле, незалежна ад механізму іх утварэння, з’яўляюцца раўнацэннымі.
Але рабіць гэта неабавязкова, бо ўсе сувязі ў малекуле, незалежна ад механізму іх утварэння, з’яўляюцца раўнацэннымі.
Аналагічным чынам можна ўявіць утварэнне хімічнай сувязі ў катыёнаў гідраксонію H3O+: у выніку гідратацыі іона вадароду ў водных растворах непадзеленая электронная пара атама кіслароду ў малекуле вады размяшчаецца на свабоднай 1s-арбіталі іона вадароду.
Донарна-акцэптарным механізмам тлумачаць утварэнне кавалентнай сувязі ў малекулах чаднага газу ![]() , азотнай кіслаты
, азотнай кіслаты 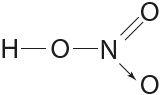 і інш.
і інш.
Іонная сувязь
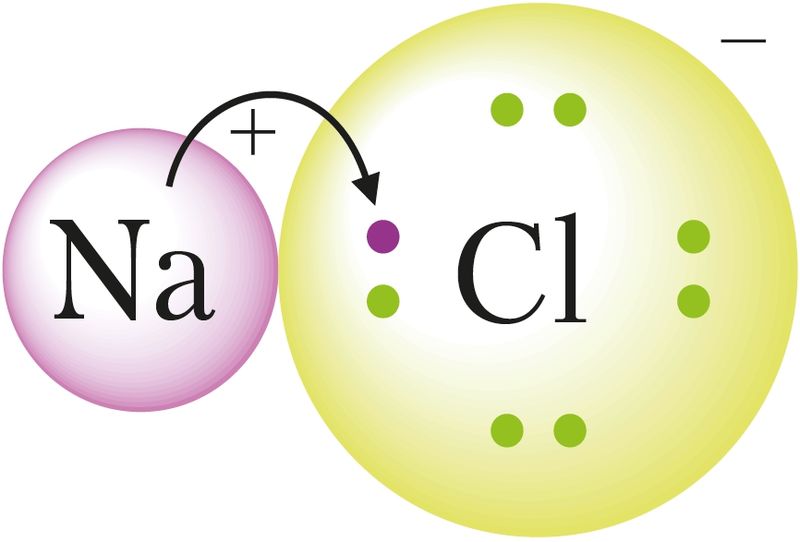
Іонная сувязь — гэта хімічная сувязь, якая ўтвараецца ў выніку электрастатычнага прыцяжэння процілегла зараджаных іонаў.
У выпадку кавалентнай сувязі валентныя электроны, якія ўдзельнічаюць у яе ўтварэнні, лакалізаваны паміж двума звязанымі атамамі. Пры ўтварэнні іоннай сувязі лічыцца, што электроны, наадварот, цалкам перайшлі ад аднаго атама да другога. У выніку такога пераходу электронаў утвараюцца іоны.
Утварэнне іонаў у крышталях хларыду натрыю пакажам, зыходзячы з электроннай канфігурацыі атамаў натрыю і хлору, наступным чынам:
11Na 1s22s22p63s1 – e– → 11Na+ 1s22s22p6 (ці Na – e– → Na+),
у скарочаным выглядзе [Ne]3s1 – e– → [Ne];
17Cl 1s22s22p63s23p5 + e– → 17Cl– 1s22s22p63s23p6 (ці Cl + e– → Cl–),
у скарочаным выглядзе [Ne]3s23p5 + e– → [Ar].
Іоны, якія ўтвараюцца, набываюць канфігурацыю найбліжэйшага высакароднага газу з актэтам электронаў на знешнім слоі ns2nр6.
Пераход электронаў можна паказаць і з дапамогай электронных формул:
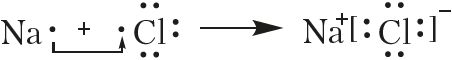
З прыведзеных схем вынікае, што валентны электрон атама натрыю цалкам пераходзіць на валентную абалонку атама хлору. Гэта прыводзіць да ўзнікнення іонаў з процілеглымі зарадамі.
Адзначым, што для іонных злучэнняў структурныя формулы не складаюць.
Узнікае пытанне: чаму ў выпадку HCl утвараецца кавалентная, а ў выпадку NaCl — іонная сувязь? Гэта тлумачыцца адрозненнем значэнняў электраадмоўнасці атамаў, якія ўзаемадзейнічаюць. Рознасць паміж значэннямі электраадмоўнасці атамаў H і Cl значна меншая, чым рознасць паміж значэннямі электраадмоўнасці Na і Cl. Гэта азначае, што хлор значна мацней прыцягвае да сябе электрон натрыю, чым электрон вадароду. У выніку адбываецца поўны пераход электрона ад атама натрыю да атама хлору.
Іонная сувязь галоўным чынам утвараецца ў галагенідах, гідраксідах і аксідах шчолачных і шчолачназямельных металаў. Да гэтага тыпу таксама адносяць сувязь паміж катыёнам і аніёнам складанага саставу, напрыклад у солях кіслародзмяшчальных кіслот (Na2SO4, NaNO3, (NH4)2SO4). У такіх рэчывах існуе два тыпы сувязей: іонная — паміж катыёнам і аніёнам, і кавалентная — паміж атамамі неметалаў унутры катыёна або аніёна складанага саставу (мал. 25).
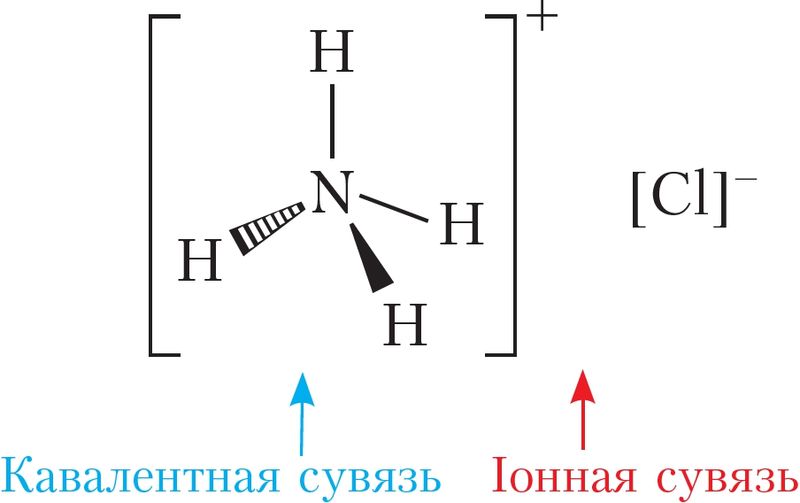
Металічная сувязь
Металічная сувязь утвараецца ў крышталях металаў і металічных сплаваў за кошт абагульвання ўсімі атамамі іх валентных электронаў.
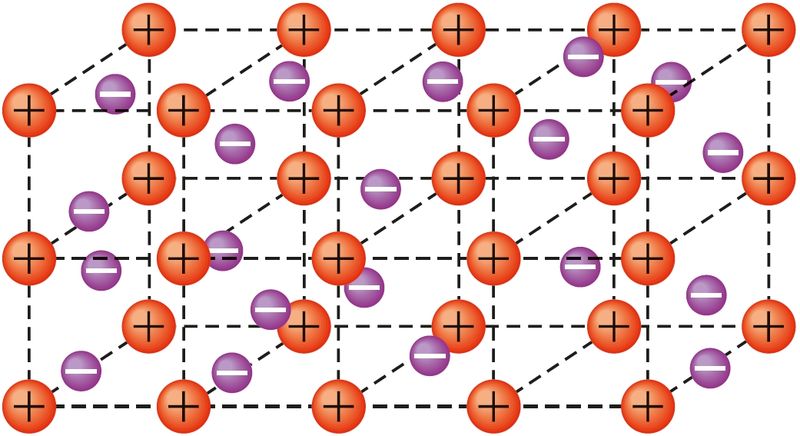
Перадача атамамі металаў сваіх валентных электронаў у калектыўнае карыстанне, наяўнасць у металаў свабодных электронаў — прычына электрычнай праводнасці. Утварэнне металічнай сувязі можна апісаць наступным чынам. У атамах металаў на знешнім энергетычным узроўні ўтрымліваецца невялікая колькасць валентных электронаў. У любым перыядзе перыядычнай сістэмы атамы металаў маюць у параўнанні з атамамі неметалаў большы радыус, меншую колькасць валентных электронаў і самы малы зарад ядра. Таму валентныя электроны адносна слаба звязаныя з ядрамі атамаў і могуць лёгка перамяшчацца па ўсім крышталі металу. У выніку крышталь складаецца з дадатна зараджаных іонаў, паміж якімі перамяшчаюцца свабодныя электроны, так званы электронны газ (мал. 26).
У табліцы 11 падсумаваны звесткі пра механізмы ўтварэння хімічных сувязей і размеркаванне электроннай шчыльнасці паміж хімічна звязанымі атамамі.
Табліца 11. Утварэнне кавалентнай, іоннай і металічнай сувязей
| Тып сувязі | Характар абмену электронамі паміж атамамі | Умовы ўзаемадзеяння паміж атамамі |
| Кавалентная сувязь | Лакалізацыя электронных пар валентных электронаў паміж дадатна зараджанымі ядрамі атамаў. Узнікае пераважна паміж атамамі неметалаў у малекулах і атамных крышталях |
 |
| Іонная сувязь | Перадача электронаў ад аднаго атама другому і ўтварэнне крышталя з катыёнаў і аніёнаў. Узнікае паміж атамамі тыповых металаў і неметалаў, у солях, многіх аксідах, гідраксідах |
 |
| Металічная сувязь | Абагульванне валентных электронаў і іх раўнамернае размеркаванне ў прасторы паміж усімі атамнымі ядрамі. Узнікае ў металах і сплавах |
 |
Хімічная сувязь — гэта ўзаемадзеянне, у выніку якога асобныя атамы аб’ядноўваюцца ў больш устойлівыя складаныя сістэмы (малекулы, крышталі, іоны і інш.).
Хімічная сувязь мае электрастатычную прыроду.
Пры ўтварэнні хімічнай сувязі поўная энергія сістэмы ядраў і электронаў паніжаецца.
Вылучаюць тры асноўныя тыпы хімічнай сувязі: кавалентная, іонная і металічная, адрозныя характарам размеркавання электроннай шчыльнасці паміж атамамі, якія ўзаемадзейнічаюць.
Існуе два механізмы ўтварэння кавалентнай сувязі — абменны і донарна-акцэптарны.
Пытанні, заданні, задачы
1. Вызначце тып хімічнай сувязі, прадстаўлены электроннымі схемамі:
| а) | в) | ||
| б) | г) |
2. Складзіце электронныя формулы малекул вадароду, хлору, хлоравадароду, вады, аміяку і ўкажыце лік звязаных і непадзеленых электронных пар у кожнай з іх.
3. Укажыце тып хімічнай сувязі паміж атамамі ў наступных злучэннях:
- а) СaCl2, BaO, S8, CaF2, CCl4, сплаў Fe—C;
- б) I2, SiO2, Na2S, О3, C2H5OH, сплаў Au—Cu.
4. Параўнайце электронныя схемы і электронныя канфігурацыі:
- а) атама Li і іона Li+ у брамідзе літыю;
- б) атама Сl і іона Сl– у хларыдзе калію;
- в) атама S і атама серы ў малекуле серавадароду.
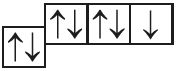
5. Назавіце механізм утварэння сувязі паміж атамамі, якія маюць наступныя электронна-графічныя схемы знешніх электронных абалонак:
- а)
и
- б)
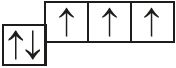 и
и 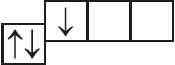
- в)
и
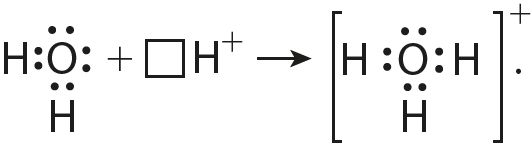
6. Згодна з прыведзенай схемай растлумачце механізм утварэння кавалентнай сувязі ў іоне гідраксонію пры ўзаемадзеянні малекулы вады і іона вадароду:
7. Выкарыстоўваючы значэнні электраадмоўнасці элементаў (табл. 7), абгрунтуйце тып хімічнай сувязі ў рэчывах і часціцах: ,
,
,
,
,
.
| Хімічная формула рэчыва або часціцы | Электраадмоўнасць атамаў | Рознасць электраадмоўнасцей ∆χ |
Тып хімічнай сувязі | |
| χ1 | χ2 | |||
8. Укажыце злучэнні, якія маюць як кавалентную, так і іонную сувязь: НСООН, CH3COONa, MgF2, MgSO4, NH4NO3, HNO3, KNO3, CaSO4, NH3.
9. Вызначце лік электронаў, якія ўдзельнічаюць ва ўтварэнні кавалентных сувязей у іонах амонію колькасцю 3 моль.
10. Пры ўтварэнні метану з атамаў вугляроду і вадароду вылучаецца 1662 кДж/моль энергіі. Вылічыце сярэднюю энергію сувязі С—Н (кДж/моль).
*Самакантроль
1. Правільнымі з’яўляюцца сцвярджэнні:
- а) хімічная сувязь мае электрастатычную прыроду;
- б) энергія двух асобных атамаў Сl меншая за энергію двух звязаных атамаў Cl;
- в) атам вугляроду мае чатыры валентныя электроны;
- г) разрыў хімічнай сувязі суправаджаецца паглынаннем энергіі.
2. За кошт агульных электронных пар утвараюцца сувязі:
- а) кавалентная палярная;
- б) іонная;
- в) металічная;
- г) кавалентная непалярная.
3. Іонная сувязь існуе ў злучэннях:
- а) О2;
- б) СsCl;
- в) Mg(NO3)2;
- г) Н2О.
4. Азот выступіў донарам электроннай пары ў злучэннях:
- а) NН3;
- б) NH4NO3;
- в) NCl3;
- г) (NH4)2SO4.
5. Электронную канфігурацыю, падобную да канфігурацыі атама аргону, мае іон:
- а) Са2+;
- б) F–;
- в) Na+;
- г) S2–.