§ 13. Прырода і тыпы хімічнай сувязі
Металічная сувязь
Металічная сувязь утвараецца ў крышталях металаў і металічных сплаваў за кошт абагульвання ўсімі атамамі іх валентных электронаў.
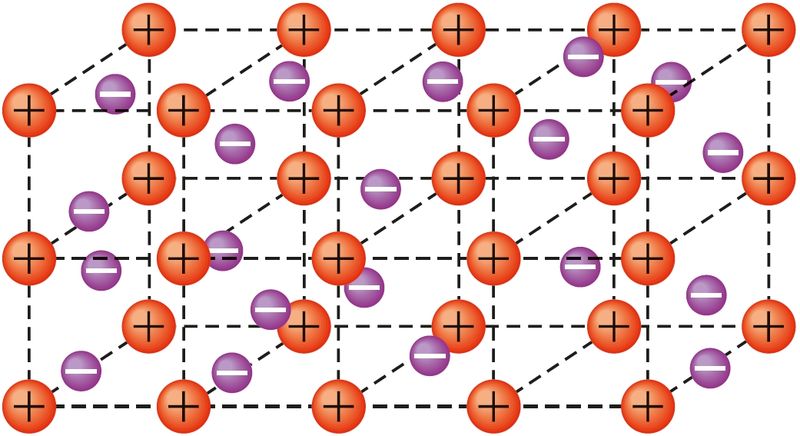
Перадача атамамі металаў сваіх валентных электронаў у калектыўнае карыстанне, наяўнасць у металаў свабодных электронаў — прычына электрычнай праводнасці. Утварэнне металічнай сувязі можна апісаць наступным чынам. У атамах металаў на знешнім энергетычным узроўні ўтрымліваецца невялікая колькасць валентных электронаў. У любым перыядзе перыядычнай сістэмы атамы металаў маюць у параўнанні з атамамі неметалаў большы радыус, меншую колькасць валентных электронаў і самы малы зарад ядра. Таму валентныя электроны адносна слаба звязаныя з ядрамі атамаў і могуць лёгка перамяшчацца па ўсім крышталі металу. У выніку крышталь складаецца з дадатна зараджаных іонаў, паміж якімі перамяшчаюцца свабодныя электроны, так званы электронны газ (мал. 26).
У табліцы 11 падсумаваны звесткі пра механізмы ўтварэння хімічных сувязей і размеркаванне электроннай шчыльнасці паміж хімічна звязанымі атамамі.
Табліца 11. Утварэнне кавалентнай, іоннай і металічнай сувязей
| Тып сувязі | Характар абмену электронамі паміж атамамі | Умовы ўзаемадзеяння паміж атамамі |
| Кавалентная сувязь | Лакалізацыя электронных пар валентных электронаў паміж дадатна зараджанымі ядрамі атамаў. Узнікае пераважна паміж атамамі неметалаў у малекулах і атамных крышталях |
 |
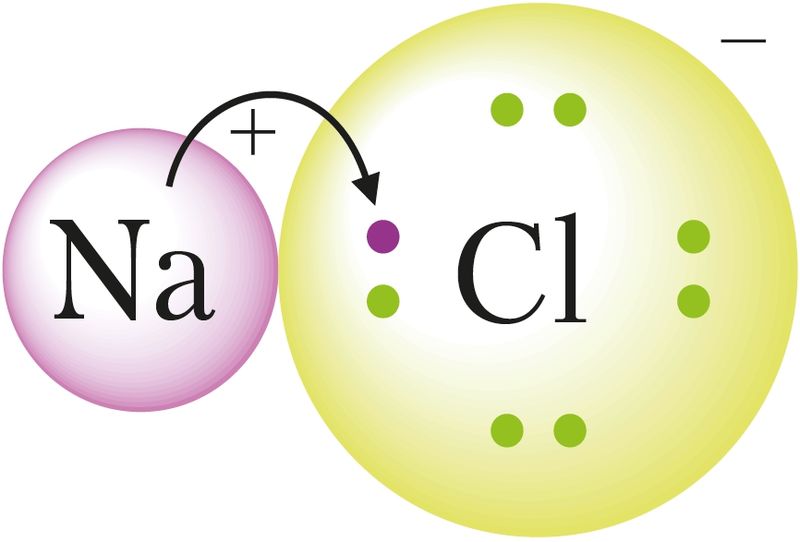
| Іонная сувязь | Перадача электронаў ад аднаго атама другому і ўтварэнне крышталя з катыёнаў і аніёнаў. Узнікае паміж атамамі тыповых металаў і неметалаў, у солях, многіх аксідах, гідраксідах |
 |
| Металічная сувязь | Абагульванне валентных электронаў і іх раўнамернае размеркаванне ў прасторы паміж усімі атамнымі ядрамі. Узнікае ў металах і сплавах |
 |