§ 13. Прырода і тыпы хімічнай сувязі
Іонная сувязь
Іонная сувязь — гэта хімічная сувязь, якая ўтвараецца ў выніку электрастатычнага прыцяжэння процілегла зараджаных іонаў.
У выпадку кавалентнай сувязі валентныя электроны, якія ўдзельнічаюць у яе ўтварэнні, лакалізаваны паміж двума звязанымі атамамі. Пры ўтварэнні іоннай сувязі лічыцца, што электроны, наадварот, цалкам перайшлі ад аднаго атама да другога. У выніку такога пераходу электронаў утвараюцца іоны.
Утварэнне іонаў у крышталях хларыду натрыю пакажам, зыходзячы з электроннай канфігурацыі атамаў натрыю і хлору, наступным чынам:
11Na 1s22s22p63s1 – e– → 11Na+ 1s22s22p6 (ці Na – e– → Na+),
у скарочаным выглядзе [Ne]3s1 – e– → [Ne];
17Cl 1s22s22p63s23p5 + e– → 17Cl– 1s22s22p63s23p6 (ці Cl + e– → Cl–),
у скарочаным выглядзе [Ne]3s23p5 + e– → [Ar].
Іоны, якія ўтвараюцца, набываюць канфігурацыю найбліжэйшага высакароднага газу з актэтам электронаў на знешнім слоі ns2nр6.
Пераход электронаў можна паказаць і з дапамогай электронных формул:
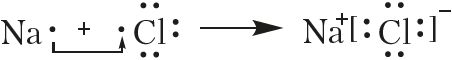
З прыведзеных схем вынікае, што валентны электрон атама натрыю цалкам пераходзіць на валентную абалонку атама хлору. Гэта прыводзіць да ўзнікнення іонаў з процілеглымі зарадамі.
Адзначым, што для іонных злучэнняў структурныя формулы не складаюць.
Узнікае пытанне: чаму ў выпадку HCl утвараецца кавалентная, а ў выпадку NaCl — іонная сувязь? Гэта тлумачыцца адрозненнем значэнняў электраадмоўнасці атамаў, якія ўзаемадзейнічаюць. Рознасць паміж значэннямі электраадмоўнасці атамаў H і Cl значна меншая, чым рознасць паміж значэннямі электраадмоўнасці Na і Cl. Гэта азначае, што хлор значна мацней прыцягвае да сябе электрон натрыю, чым электрон вадароду. У выніку адбываецца поўны пераход электрона ад атама натрыю да атама хлору.
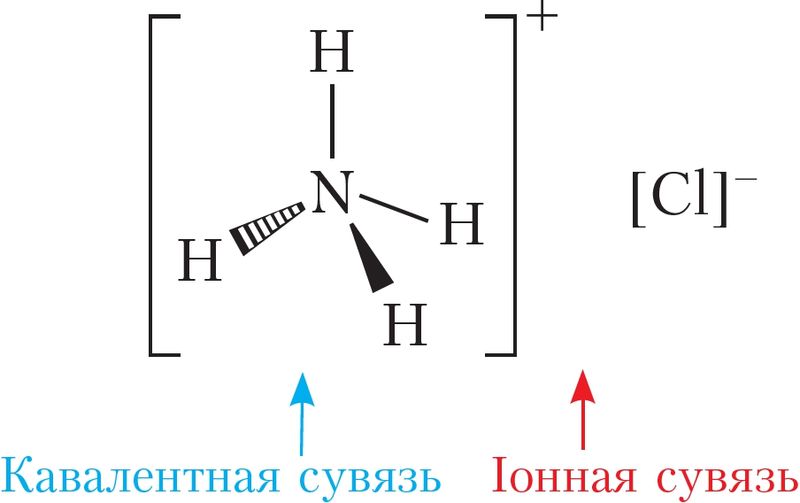
Іонная сувязь галоўным чынам утвараецца ў галагенідах, гідраксідах і аксідах шчолачных і шчолачназямельных металаў. Да гэтага тыпу таксама адносяць сувязь паміж катыёнам і аніёнам складанага саставу, напрыклад у солях кіслародзмяшчальных кіслот (Na2SO4, NaNO3, (NH4)2SO4). У такіх рэчывах існуе два тыпы сувязей: іонная — паміж катыёнам і аніёнам, і кавалентная — паміж атамамі неметалаў унутры катыёна або аніёна складанага саставу (мал. 25).