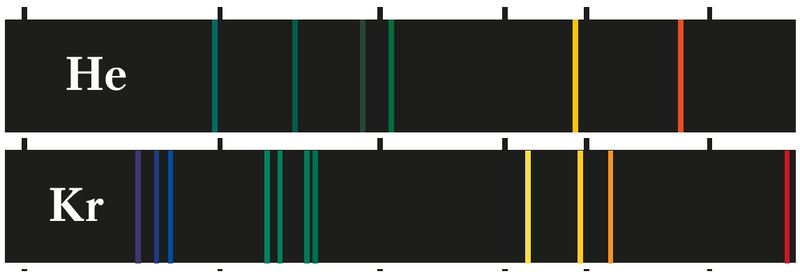
§ 9. Стан электрона ў атаме
Атамныя арбіталі, парадак іх запаўнення электронамі
На энергетычнай дыяграме атамныя арбіталі намаляваны ў выглядзе клетак (ячэек): (мал. 18). На кожным энергетычным падузроўні можа знаходзіцца толькі пэўны лік аднолькавых па энергіі атамных арбіталей: на любым s-падузроўні — адна
, на p — тры
, на d — пяць
.
Як вам ужо вядома, на кожнай атамнай арбіталі можа размясціцца не больш за два электроны: , прычым электроны павінны адрознівацца сваімі спінамі. Спін умоўна характарызуе вярчэнне электрона вакол уласнай восі па гадзіннікавай стрэлцы або супраць яе. Гэтыя адрозненні ў электронаў на схеме малююць стрэлкамі, накіраванымі ў процілеглыя бакі. Калі на арбіталі знаходзіцца адзін электрон
, яго называюць няспараным, а атамную арбіталь — напалову запоўненай. Калі на арбіталі два электроны
, то электроны называюць спаранымі, а арбіталь — запоўненай. Атамную арбіталь без электронаў называюць вакантнай, або свабоднай
.
Умяшчальнасць энергетычных узроўняў паказана ў табліцы 5.
Вам вядомыя тры спосабы адлюстравання размеркавання электронаў у атаме:
1) у выглядзе электронных схем (паказваюць размеркаванне электронаў толькі па энергетычных узроўнях), напрыклад для вугляроду 6С 2е–, 4е–;
2) у выглядзе формулы электроннай канфігурацыі (паказваюць размеркаванне электронаў па арбіталях), напрыклад 6С 1s22s22p2, дзе лічбы перад літарамі s і p паказваюць нумар энергетычнага ўзроўню, літары s і p — форму электроннага воблака, а верхні індэкс над літарамі — лік электронаў, размешчаных на падузроўнях;
3) з дапамогай электронна-графічных схем (паказваюць размеркаванне электронаў па арбіталях з улікам спіна электрона), напрыклад:
6C 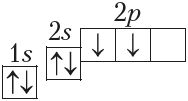
Электронна-графічная схема — гэта тая ж энергетычная дыяграма, але з адлюстраваннем запаўнення электронамі атамных арбіталей. Стан атама з найменшай магчымай для яго энергіяй электронаў называюць асноўным, або няўзбуджаным, станам. Усе іншыя энергетычныя станы гэтага атама, якім адпавядае большая энергія электронаў, чым у асноўным стане, называюцца ўзбуджанымі.
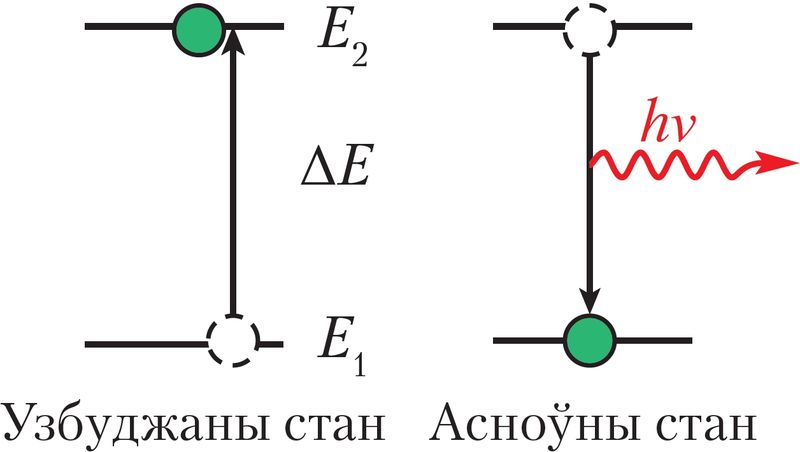
Для таго каб перавесці атам ва ўзбуджаны стан, яму трэба надаць энергію — энергію ўзбуджэння (ΔE) (мал. 19). Яна перадаецца пры ўздзеянні на атам электрамагнітнага выпраменьвання (напрыклад, сонечнага святла), пры награванні або ўздзеянні на атам хуткіх электронаў. У асноўным стане атам можа знаходзіцца неабмежавана доўга, а ва ўзбуджаным — каля 10–15 с, пасля чаго ўзбуджаныя электроны вяртаюцца ў асноўны стан. Пераход атама з узбуджанага стану ў асноўны суправаджаецца электрамагнітным выпраменьваннем.