§ 9. Стан электрона ў атаме
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 9. Стан электрона ў атаме |
| Напечатано:: | Гость |
| Дата: | Пятница, 27 Июнь 2025, 04:22 |

Развіццё квантавай механікі ў 20-я гады ХХ стагоддзя прывяло да карэннага перагляду фундаментальных паняццяў тэорыі будовы атама. Даследаванне ўласцівасцей электрона паказала, што для яго характэрны ўласцівасці як часціцы, так і хвалі. Электрон як часціца характарызуецца масай і электрычным зарадам, як хваля — даўжынёй хвалі, якая залежыць ад скорасці руху электрона. Гэтую дваістасць уласцівасцей электрона назвалі карпускулярна-хвалевым дуалізмам.
У цяперашні час хвалевыя ўласцівасці электрона выкарыстоўваюцца ў электроннай і атамна-сілавой мікраскапіі, якая дазваляе разглядаць розныя аб’екты (памерам парадку 10–9 м) з павелічэннем у сотні тысяч разоў (мал. 15). Без гэтых метадаў было б немагчымым з’яўленне нанатэхналогій.
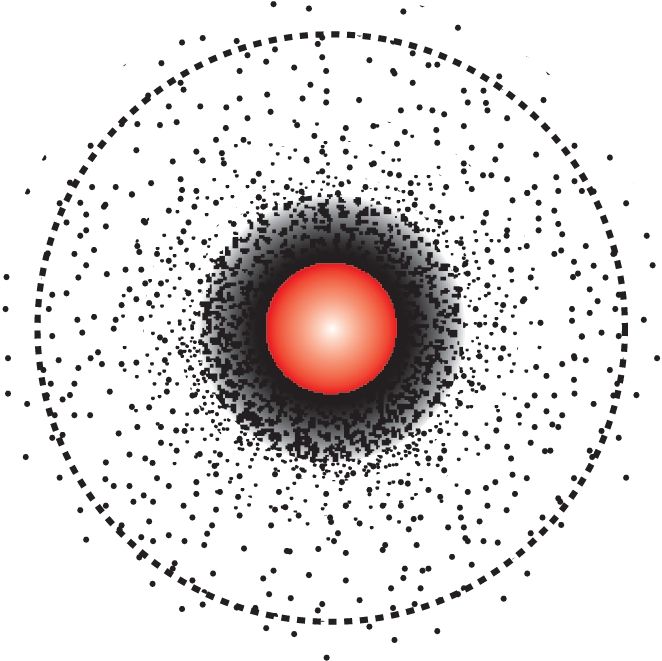
З пункту гледжання квантавай механікі для электрона нельга адначасова дакладна вызначыць яго каардынату і скорасць, а значыць, немагчыма прасачыць траекторыю руху электрона ў атаме, таму кажуць пра верагоднасць знаходжання электрона ў пэўнай вобласці прасторы каля ядра. Яе абмяжоўваюць умоўнай паверхняй, якая ахоплівае прыкладна 90 % аб’ёму, у якім найбольш вялікая верагоднасць знаходжання гэтага электрона (мал. 16). Такую вобласць каляядзернай прасторы называюць атамнай электроннай арбіталлю, ці проста атамнай арбіталлю.
Кожнаму электрону ў атаме адпавядае свая атамная арбіталь, якая характарызуецца пэўнымі значэннямі энергіі, формай і памерам электроннага воблака.
За ўмоўны памер атамнай s-арбіталі прымаюць дыяметр воблака, у якім верагоднасць знаходжання дадзенага электрона складае прыкладна 90 % (гл. пункцірную лінію на мал. 16).
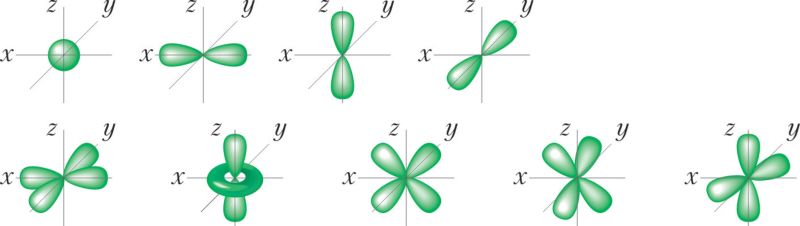
Па форме электроннага воблака адрозніваюць s-, p-, d- і f-арбіталі. s-Арбіталі маюць форму сферы, р — форму гантэлі, d і f — больш складаную форму (мал. 17).
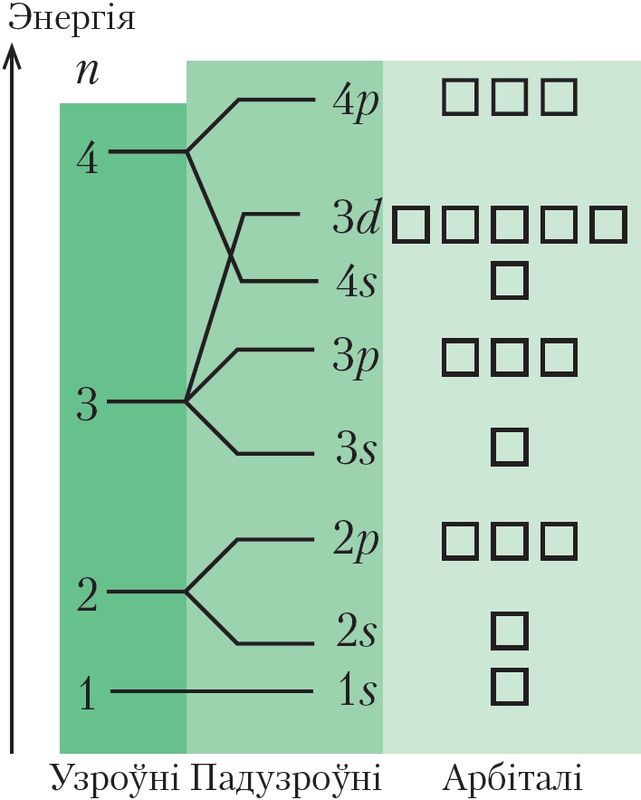
Згодна з асноўным прынцыпам квантавай механікі, электрон у атаме можа прымаць толькі пэўныя значэнні энергіі, а іншыя значэнні забароненыя. У гэтым выпадку кажуць, што энергія электрона квантаваная, гэта значыць мае дыскрэтны набор значэнняў. Для нагляднага ўяўлення станаў электронаў у атаме выкарыстоўваюць энергетычную дыяграму (мал. 18). Прааналізуем гэты малюнак. З малюнка вынікае, што электроны ў атаме размеркаваны па энергетычных узроўнях і падузроўнях.
Энергетычныя ўзроўні (або электронныя пласты, з якімі вы пазнаёміліся, вывучаючы хімію ў 9-м класе) абазначаюць лікам n. Гэты лік мае толькі цэлалікавыя значэнні: 1, 2, 3, ... Кожнаму значэнню n адпавядае пэўнае значэнне энергіі электрона. Энергія можа змяняцца толькі скачкападобна. Самы нізкі энергетычны ўзровень (n = 1) адпавядае мінімальна магчымай энергіі электрона. Электроны, якія знаходзяцца на гэтым узроўні, найбольш моцна звязаныя з ядром. Чым большы n, слабейшая яго сувязь з ядром, большы памер электроннага воблака, тым большая энергія электрона. Пры n = ∞ электрон губляе сувязь з ядром і лічыцца свабодным.
Вам ужо вядома, што лік электронаў на энергетычных узроўнях розны. Так, на першым энергетычным узроўні можа быць не больш за 2, на другім — не больш за 8, на трэцім — не больш за 18 электронаў.
Лік электронаў, які можа змясціць пэўны ўзровень, можна вылічыць па формуле:
N(e–) = 2n2.
Электроны, якія знаходзяцца на адным энергетычным узроўні, утвараюць электронную абалонку, або слой. Найвышэйшую па энергіі электронную абалонку называюць знешняй. На ёй размешчаны электроны, якія слабей за ўсё звязаны з ядром і таму здольныя ўдзельнічаць ва ўтварэнні хімічных сувязей. Іх называюць валентнымі.
У шматэлектронных атамах энергетычныя ўзроўні расшчапляюцца на энергетычныя падузроўні (табл. 5). На першым узроўні (n = 1) ёсць толькі адзін падузровень — 1s, на другім (n = 2) — два падузроўні (2s і 2p), на трэцім іх тры (3s, 3p і 3d).
Табліца 5. Размеркаванне электронаў у атаме па ўзроўнях, падузроўнях, арбіталях
| Энергетычны ўзровень, n | Падузровень | Лік атамных арбіталей | Максімальны лік электронаў на падузроўні | Максімальны лік электронаў на энергетычным узроўні (N(e–) = 2n2) |
| 1 | 1s | 1 | 2 | 2 |
| 2 |
2s 2p |
1 3 |
2 6 |
8 |
| 3 |
3s 3p 3d |
1 3 5 |
2 6 10 |
18 |
f-Электронныя воблакі
Існуе 7 f-атамных арбіталей, на якіх можа размясціцца 14 электронаў. Ім адпавядаюць 7 электронных воблакаў, форма якіх паказана на малюнку 17.1.
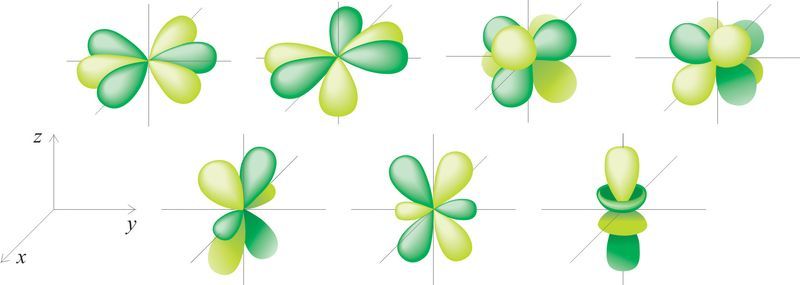
Атамныя арбіталі, парадак іх запаўнення электронамі
На энергетычнай дыяграме атамныя арбіталі намаляваны ў выглядзе клетак (ячэек): (мал. 18). На кожным энергетычным падузроўні можа знаходзіцца толькі пэўны лік аднолькавых па энергіі атамных арбіталей: на любым s-падузроўні — адна
, на p — тры
, на d — пяць
.
Як вам ужо вядома, на кожнай атамнай арбіталі можа размясціцца не больш за два электроны: , прычым электроны павінны адрознівацца сваімі спінамі. Спін умоўна характарызуе вярчэнне электрона вакол уласнай восі па гадзіннікавай стрэлцы або супраць яе. Гэтыя адрозненні ў электронаў на схеме малююць стрэлкамі, накіраванымі ў процілеглыя бакі. Калі на арбіталі знаходзіцца адзін электрон
, яго называюць няспараным, а атамную арбіталь — напалову запоўненай. Калі на арбіталі два электроны
, то электроны называюць спаранымі, а арбіталь — запоўненай. Атамную арбіталь без электронаў называюць вакантнай, або свабоднай
.
Умяшчальнасць энергетычных узроўняў паказана ў табліцы 5.
Вам вядомыя тры спосабы адлюстравання размеркавання электронаў у атаме:
1) у выглядзе электронных схем (паказваюць размеркаванне электронаў толькі па энергетычных узроўнях), напрыклад для вугляроду 6С 2е–, 4е–;
2) у выглядзе формулы электроннай канфігурацыі (паказваюць размеркаванне электронаў па арбіталях), напрыклад 6С 1s22s22p2, дзе лічбы перад літарамі s і p паказваюць нумар энергетычнага ўзроўню, літары s і p — форму электроннага воблака, а верхні індэкс над літарамі — лік электронаў, размешчаных на падузроўнях;
3) з дапамогай электронна-графічных схем (паказваюць размеркаванне электронаў па арбіталях з улікам спіна электрона), напрыклад:
6C 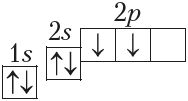
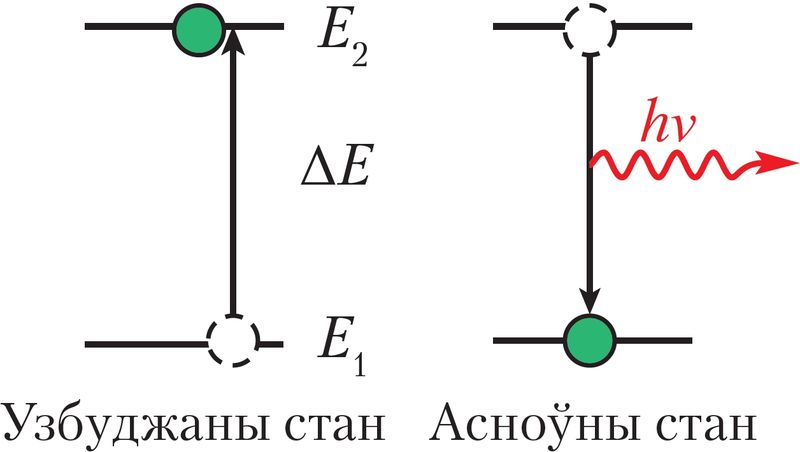
Электронна-графічная схема — гэта тая ж энергетычная дыяграма, але з адлюстраваннем запаўнення электронамі атамных арбіталей. Стан атама з найменшай магчымай для яго энергіяй электронаў называюць асноўным, або няўзбуджаным, станам. Усе іншыя энергетычныя станы гэтага атама, якім адпавядае большая энергія электронаў, чым у асноўным стане, называюцца ўзбуджанымі.
Для таго каб перавесці атам ва ўзбуджаны стан, яму трэба надаць энергію — энергію ўзбуджэння (ΔE) (мал. 19). Яна перадаецца пры ўздзеянні на атам электрамагнітнага выпраменьвання (напрыклад, сонечнага святла), пры награванні або ўздзеянні на атам хуткіх электронаў. У асноўным стане атам можа знаходзіцца неабмежавана доўга, а ва ўзбуджаным — каля 10–15 с, пасля чаго ўзбуджаныя электроны вяртаюцца ў асноўны стан. Пераход атама з узбуджанага стану ў асноўны суправаджаецца электрамагнітным выпраменьваннем.
Для электрона характэрны ўласцівасці як часціцы, так і хвалі.
Атамная арбіталь — гэта характарыстыка стану электрона ў атаме, якая ўключае пэўнае значэнне энергіі, форму і памер электроннага воблака.
Электронную будову атама характарызуюць з дапамогай электроннай схемы, формулы электроннай канфігурацыі і электронна-графічнай схемы.
Пытанні, заданні, задачы
1. Назавіце характарыстыкі электрона:
- а) як часціцы;
- б) як хвалі.
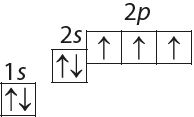
2. Назавіце спосабы адлюстравання размеркавання электронаў у атаме азоту:
- а) 7N 2е–,5е–;
- б) 7N 1s22s22p3;
- в) 7N
3. Як зменіцца энергія электрона, калі яго перавесці са стану з n = 2 у стан з n = 3? Што адбудзецца з энергіяй электрона, калі ён вернецца ў ранейшы стан?
4. Выкарыстоўваючы малюнак 18, расстаўце наступныя атамныя арбіталі ў парадку павелічэння іх энергіі: 3p, 2p, 3d, 1s.
5. У якім стане энергія электрона вышэйшая: 2s або 2p; 3p або 2p?
6. Чым адрозніваюцца атамныя арбіталі 1s і 3s?
7. Колькі ўсяго электронаў можа знаходзіцца на трэцім энергетычным узроўні, на 1s-падузроўні, на 2р-падузроўні, на 3d-падузроўні?
8. Пры ўзбуджэнні электрон перайшоў з 2s- на 2р-арбіталь. Што пры гэтым змянілася:
энергія электрона, форма электроннага воблака, зарад атама, энергія атама?
9. Разлічыце лік электронаў у порцыі фосфару масай 1,24 г.
10. Порцыя нітрату двухвалентнага металу колькасцю 0,2 моль змяшчае 16,4 моль электронаў. Вызначце элемент.
*Самакантроль
1. Карпускулярна-хвалевы дуалізм разглядае электрон толькі як:
- а) хвалю;
- б) часціцу;
- в) карпускулу;
- г) і хвалю, і часціцу адначасова.
2. Пакажыце выявы р-арбіталі:

3. Электронна-графічнай схемай атама вугляроду ў асноўным стане з’яўляецца:
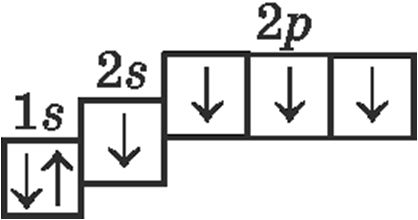
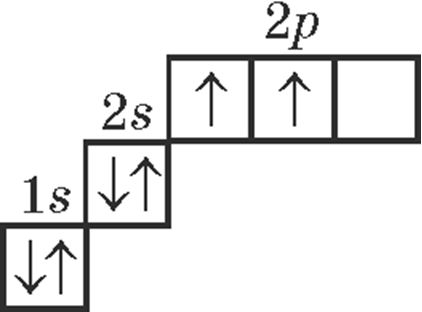
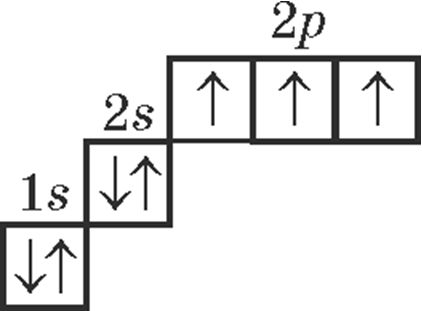
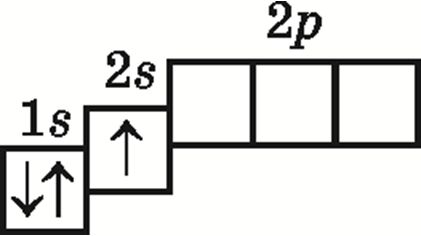
4. Правільнымі з’яўляюцца сцвярджэнні:
- а) стан атама з найменшай магчымай для яго энергіяй называюць няўзбуджаным;
- б) найбольш моцна з ядром звязаны электроны першага ўзроўню;
- в) лік электронаў на энергетычным узроўні n вызначаецца па формуле N = 2n2;
- г) спін умоўна характарызуе кручэнне электрона вакол уласнай восі.
5. У парадку павелічэння энергіі атамныя арбіталі ўказаны ў радах:
- а) 2р, 2s, 3d;
- б) 1s, 3s, 3d;
- в) 1s, 3s, 2p;
- г) 3p, 4s, 3d.