§ 48.1. Общая характеристика металлов B-групп
Особенности свойств металлов В-групп
Особенность свойств соединений, которые образуют d-элементы, определяется электронным строением внешнего и предвнешнего электронных слоёв их атомов.
Атомы d-элементов B-групп по размеру меньше, чем атомы соседних по периоду ns-элементов, поскольку электроны заполняют внутренний энергетический (n – 1)d-подуровень. Если дополнительно учесть, что у атомов d-элементов структура внешнего электронного слоя примерно одинакова (ns1 или ns2), то становится понятной причина менее резкого изменения по периоду свойств d-элементов по сравнению с s- и р-элементами.
Простые вещества d-элементов — типичные металлы, что объясняется сравнительно слабой связью внешних электронов с ядром.
Участие d-электронов в образовании металлической связи в простых веществах приводит к её упрочнению по сравнению со связью в металлах s- и p-элементов. Следствием этого являются характерные для ряда металлов d-элементов (например, хром, вольфрам) высокая температура плавления (кроме ртути), большая плотность (исключение титан), твёрдость. Некоторые d-элементы (Со, Ni) являются ферромагнетиками.
Элементы IIIВ-группы, имеющие всего один d-электрон, по химическим свойствам близки к соседним щёлочноземельным металлам.
Металлы элементов IVВ–VIВ-групп отличаются меньшей восстановительной способностью, а в ряде случаев и химической пассивностью. Они более устойчивы к коррозии.
На поверхности пассивных металлов большинства d-элементов образуется плотная оксидная плёнка, препятствующая протеканию различных химических реакций. Это свойство позволяет использовать эти металлы в качестве антикоррозионных покрытий (хромирование, никелирование, меднение).
Большинство d-металлов стоят в ряду активности металлов до водорода и вытесняют водород из кислот, например:
Cr + 2НСl = СrСl2 + Н2↑.
Металлы Сu, Hg, Ag, Аu и металлы семейства платины (Ru, Rh, Pd, Os, Ir, Pt) в ряду активности расположены после водорода, поэтому не вытесняют водород из кислот. Для перевода Сu, Hg, Ag в раствор их окисляют азотной кислотой. Au и Pt способны растворяться только в царской водке (смесь концентрированных азотной и соляной кислот) (табл. 34.2).
Таблица 34.2. Сравнение химических свойств металлов s- и d-элементов с учётом их положения в ряду активности металлов
| Металлы | Li | K | Са | Na | Mg | Al | Mn | Zn | Сr | Fe | Со | Ni | Sn | Pb | Н2 | Cu | Нg | Аg | Pt | Au |
| Характеристики | ||||||||||||||||||||
| В природе существуют | Преимущественно в виде соединений | В свободном виде и в виде соединений | Преимущественно в свободном виде | |||||||||||||||||
| Реакции с кислородом | Быстро | Медленно | Не окисляются | |||||||||||||||||
| Реакции с водой | Образуют щелочи и Н2 | С парами воды образуют оксиды металлов и Н2 | Не взаимодействуют | |||||||||||||||||
| Коррозия | Коррозионная устойчивость усиливается |
|||||||||||||||||||
| Реакции с кислотами | Из растворов кислот-неокислителей (HСl, H2SO4(разб.), H3PO4, H2S, RCOOH) вытесняют водород (Pb пассивируется в разбавленных HCl, H2SO4) |
Н2 из кислот не вытесняют | ||||||||||||||||||
| С разбавленной и концентрированной HNO3 образуют соль, воду и продукты восстановления азота(V) С концентрированной H2SO4 образуют соль, воду и продукты восстановления серы(VI) В концентрированных HNO3 и H2SO4 металлы Al, Fe, Сr, Ni пассивируются |
Растворяются в царской водке HNO3 + 3HCl | |||||||||||||||||||
| Получение | Электролиз расплавов | Восстановление оксидов металлов H2, СО, Al; электролиз растворов солей; вытеснение из растворов солей активными металлами | ||||||||||||||||||
| Соединения | Оксиды растворяются в Н2О с образованием гидроксидов | Оксиды не растворяются в воде | ||||||||||||||||||
| Гидроксиды основные | Гидроксиды и оксиды амфотерные | Гидроксиды и оксиды могут быть основными, амфотерными, кислотными | ||||||||||||||||||
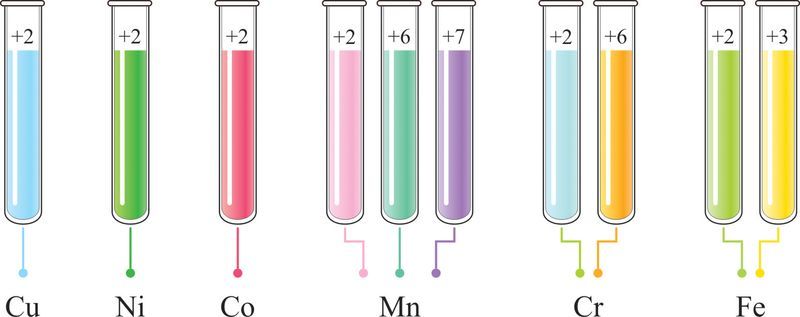
В отличие от s-элементов большинство соединений d-элементов имеют специфическую окраску, зависящую от степени окисления их атомов (рис. 112.3). Например, соединения, образованные атомами меди в степени окисления +2, окрашены в голубой цвет. Соединения Ni(II) имеют зелёную окраску, Co(II) — розовую, Mn(II) — бледно-розовую, Mn(VI) — зелёную, Mn(VII) — фиолетовую, Cr(VI) — жёлтую (K2CrO4) или оранжевую (K2Cr2O7), Cr(II) — голубую, Fe(III) — жёлтую и Fe(II) — зелёную окраску.