§ 48.1. Общая характеристика металлов B-групп
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 48.1. Общая характеристика металлов B-групп |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 1 Июнь 2025, 04:14 |
Положение в периодической системе и особенности электронного строения атомов металлов B-групп
Химические элементы В-групп расположены в периодической системе между s- и р-элементами, поэтому их называют переходными элементами.
Простые вещества, образованные этими элементами, являются металлами.
На внешнем электронном слое атомов элементов В-групп содержится 1–2 s-электрона. В периодах с увеличением порядкового номера у элементов последовательно заполняются электронами d-орбитали предвнешнего электронного слоя. Поэтому элементы В-групп относят к d-элементам. Ввиду того что существует пять d-орбиталей, в каждом периоде размещено по десять d-элементов.
При переходе в 4-м периоде от одного d-элемента к следующему вначале заполняются электронами ns-орбитали внешнего слоя и только после этого заполняются (n – 1)d-орбитали. Заполнение ns-орбиталей повышает их энергию, и они на энергетической шкале поднимаются выше (n – 1)d-орбиталей. Поэтому в формулах электронных конфигураций d-элементов (n – 1)d-орбитали записывают перед ns-орбиталями. Например, у Sc на 3d-орбитали появляется электрон после заполнения двумя электронами 4s-орбитали, однако формула электронной конфигурации Sc записывают [Ar]3d14s2.
Электронную конфигурацию валентного слоя d-элементов 4-го периода можно представить общей формулой: (n – 1)dxnsy, где x может принимать значения от 1 до 10, а y равен 1 или 2. Формулы электронной конфигурации атомов d-элементов 4-го периода приведены в таблице 34.1.
Заполнение электронами d-орбиталей происходит по тем же правилам, что и s- и р-орбиталей. Однако у элементов Cr и Cu происходит переход, или «провал», одного 4s-электрона на 3d-орбиталь предыдущего энергетического уровня. Это объясняется тем, что электронные состояния с конфигурацией 3d5(для Cr) и 3d10 (для Cu) более устойчивы, а энергии 4s- и 3d-подуровней различаются незначительно, и переход s-электрона внешнего на d-орбиталь предыдущего электронного слоя не требует больших затрат энергии.
Отрыв электронов от атомов происходит в обратной последовательности: вначале отрываются ns-электроны и только потом (n – 1)d-электроны. Например, образование иона Fe3+ можно представить схемой:
Fe0 – 3e– → Fe3+;
[Ar]3d64s2 – 3e– → [Ar]3d54s0.
Степени окисления атомов d-элементов в соединениях
В отличие от s- и р-элементов у d-элементов в образовании химических связей могут принимать участие не только s-электроны внешнего, но и d-электроны предвнешнего слоёв. Это увеличивает число возможных степеней их окисления. Кроме d-элементов IIIВ- и IIВ-групп, атомы всех остальных d-элементов имеют несколько степеней окисления (табл. 34.1).
С ростом порядкового номера элемента в периоде максимальная (высшая) степень окисления возрастает от IIIВ-группы до первого элемента VIIIВ-группы, а затем убывает. Высшая степень окисления у большинства d-элементов, как правило, отвечает номеру группы, к которой они относятся. Исключение составляют Fe, элементы подгруппы кобальта, никеля и меди (табл. 34.1).
Для атомов элементов IB-группы (Сu, Ag, Аu) возможна не только степень окисления +1 (например, в соединениях Cu2О, AgCl, Au2S), но и более высокая (например, в соединениях ,
).
Соединения элементов, в которых атомы могут находиться в степени окисления +8, известны только для рутения и осмия (например, ). Для остальных элементов VIIIВ-группы характерны более низкие степени окисления.
Максимальная степень окисления для железа равна +6 (например, в соединении K2FeO4). В ней железо является сильным окислителем.
Таблица 34.1. Формулы электронной конфигурации, число валентных электронов и характерные степени окисления* атомов 3d-элементов
| Группа | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | ||
| Элементы | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| Степени окисления | +7 | |||||||||
| +6 | +6 | +6 | ||||||||
| +5 | ||||||||||
| +4 | +4 | +4 | ||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +1 | ||||||||||
| Электронная конфигурация валентного слоя | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 | 3d104s2 |
*Наиболее устойчивые степени окисления выделены цветом
Если у элементов А-групп с увеличением порядкового номера по группе устойчивость соединений, в которых атомы элемента проявляет высшую степень окисления, уменьшается, то у элементов В-групп наблюдается обратная закономерность: по группе сверху вниз устойчивость соединений элементов в высшей степени окисления атома, как правило, повышается. Высшие степени окисления в соединениях характерны для золота (+3), платины (+4), осмия (+8), вольфрама (+6).
В низких степенях окисления атомы d-элементов образуют химические связи, близкие к ионному типу, и в растворах существуют в виде катионов, например Mn2+, Fe2+, Ag+:
MnCl2 → Mn2+ + 2Cl–.
В высших степенях окисления для d-элементов характерны анионные формы соединений с ковалентным типом химической связи, например в ионе .
Структурные формулы серной и хромовой кислоты, в которых атомы находятся в одинаковых степенях окисления, однотипны:
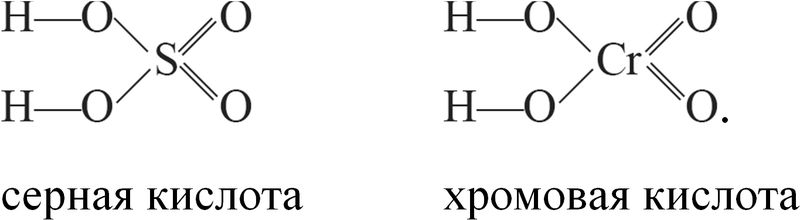
Соединения элементов В-групп в высших степенях окисления проявляют сходство в свойствах с соединениями элементов в тех же степенях окисления А-групп. У них аналогичные формулы оксидов, гидроксидов, кислот и солей. Например, хром, элемент VIB-группы, в степени окисления +6 образует кислотный оксид CrO3 и кислоту H2CrO4, которые по составу и окислительно-восстановительным свойствам аналогичны соединениям серы, элемента VIА-группы, в той же степени окисления +6: SO3 и H2SO4.
Подобное сходство характерно для марганца, элемента VIIB-группы, и хлора, элемента VIIА-группы. В степени окисления +7 марганец образует оксид Mn2O7 (молекулярная жидкость) и соответствующую ему кислоту HMnO4. Хлор в той же степени окисления (+7) образует кислотный оксид Cl2O7 (также молекулярная жидкость) и кислоту HClO4.
Близость свойств этих элементов можно объяснить одинаковым числом неспаренных электронов, которые принимают участие в образовании химических связей с кислородом.
| S | Cr | Cl |
| 6 | 6 | 7 |
Особенности свойств металлов В-групп
Особенность свойств соединений, которые образуют d-элементы, определяется электронным строением внешнего и предвнешнего электронных слоёв их атомов.
Атомы d-элементов B-групп по размеру меньше, чем атомы соседних по периоду ns-элементов, поскольку электроны заполняют внутренний энергетический (n – 1)d-подуровень. Если дополнительно учесть, что у атомов d-элементов структура внешнего электронного слоя примерно одинакова (ns1 или ns2), то становится понятной причина менее резкого изменения по периоду свойств d-элементов по сравнению с s- и р-элементами.
Простые вещества d-элементов — типичные металлы, что объясняется сравнительно слабой связью внешних электронов с ядром.
Участие d-электронов в образовании металлической связи в простых веществах приводит к её упрочнению по сравнению со связью в металлах s- и p-элементов. Следствием этого являются характерные для ряда металлов d-элементов (например, хром, вольфрам) высокая температура плавления (кроме ртути), большая плотность (исключение титан), твёрдость. Некоторые d-элементы (Со, Ni) являются ферромагнетиками.
Элементы IIIВ-группы, имеющие всего один d-электрон, по химическим свойствам близки к соседним щёлочноземельным металлам.
Металлы элементов IVВ–VIВ-групп отличаются меньшей восстановительной способностью, а в ряде случаев и химической пассивностью. Они более устойчивы к коррозии.
На поверхности пассивных металлов большинства d-элементов образуется плотная оксидная плёнка, препятствующая протеканию различных химических реакций. Это свойство позволяет использовать эти металлы в качестве антикоррозионных покрытий (хромирование, никелирование, меднение).
Большинство d-металлов стоят в ряду активности металлов до водорода и вытесняют водород из кислот, например:
Cr + 2НСl = СrСl2 + Н2↑.
Металлы Сu, Hg, Ag, Аu и металлы семейства платины (Ru, Rh, Pd, Os, Ir, Pt) в ряду активности расположены после водорода, поэтому не вытесняют водород из кислот. Для перевода Сu, Hg, Ag в раствор их окисляют азотной кислотой. Au и Pt способны растворяться только в царской водке (смесь концентрированных азотной и соляной кислот) (табл. 34.2).
Таблица 34.2. Сравнение химических свойств металлов s- и d-элементов с учётом их положения в ряду активности металлов
| Металлы | Li | K | Са | Na | Mg | Al | Mn | Zn | Сr | Fe | Со | Ni | Sn | Pb | Н2 | Cu | Нg | Аg | Pt | Au |
| Характеристики | ||||||||||||||||||||
| В природе существуют | Преимущественно в виде соединений | В свободном виде и в виде соединений | Преимущественно в свободном виде | |||||||||||||||||
| Реакции с кислородом | Быстро | Медленно | Не окисляются | |||||||||||||||||
| Реакции с водой | Образуют щелочи и Н2 | С парами воды образуют оксиды металлов и Н2 | Не взаимодействуют | |||||||||||||||||
| Коррозия | Коррозионная устойчивость усиливается |
|||||||||||||||||||
| Реакции с кислотами | Из растворов кислот-неокислителей (HСl, H2SO4(разб.), H3PO4, H2S, RCOOH) вытесняют водород (Pb пассивируется в разбавленных HCl, H2SO4) |
Н2 из кислот не вытесняют | ||||||||||||||||||
| С разбавленной и концентрированной HNO3 образуют соль, воду и продукты восстановления азота(V) С концентрированной H2SO4 образуют соль, воду и продукты восстановления серы(VI) В концентрированных HNO3 и H2SO4 металлы Al, Fe, Сr, Ni пассивируются |
Растворяются в царской водке HNO3 + 3HCl | |||||||||||||||||||
| Получение | Электролиз расплавов | Восстановление оксидов металлов H2, СО, Al; электролиз растворов солей; вытеснение из растворов солей активными металлами | ||||||||||||||||||
| Соединения | Оксиды растворяются в Н2О с образованием гидроксидов | Оксиды не растворяются в воде | ||||||||||||||||||
| Гидроксиды основные | Гидроксиды и оксиды амфотерные | Гидроксиды и оксиды могут быть основными, амфотерными, кислотными | ||||||||||||||||||
В отличие от s-элементов большинство соединений d-элементов имеют специфическую окраску, зависящую от степени окисления их атомов (рис. 112.3). Например, соединения, образованные атомами меди в степени окисления +2, окрашены в голубой цвет. Соединения Ni(II) имеют зелёную окраску, Co(II) — розовую, Mn(II) — бледно-розовую, Mn(VI) — зелёную, Mn(VII) — фиолетовую, Cr(VI) — жёлтую (K2CrO4) или оранжевую (K2Cr2O7), Cr(II) — голубую, Fe(III) — жёлтую и Fe(II) — зелёную окраску.
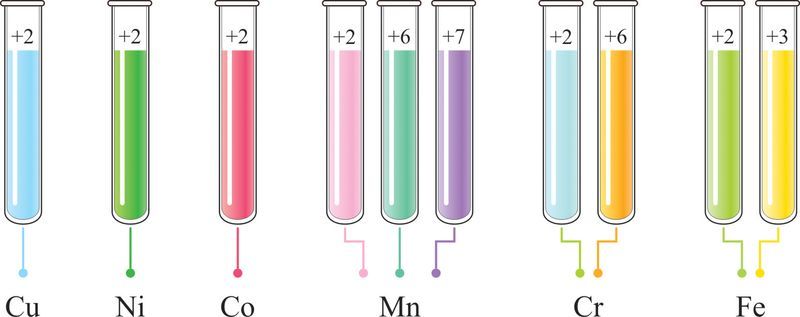
Металлы В-групп относят к d-элементам с общей электронной конфигурацией валентного слоя (n – 1)dxnsy, где x может принимать значения от 1 до 10.
При образовании химических связей в атомах d-элементов принимают участие не только s-электроны внешнего, но и d-электроны предвнешнего слоёв.
Кроме d-элементов IIIВ- и IIВ-групп, атомы всех остальных d-элементов имеют несколько степеней окисления. Высшая степень окисления атомов, как правило, соответствует номеру группы d-элемента.
В низких степенях окисления атомы d-элементов образуют химические связи, близкие к ионному типу, и в растворах существуют в виде катионов.
В высших степенях окисления для d-элементов характерны анионные формы соединений.
Вопросы, задания, задачи
1. Приведите формулы и схемы электронных конфигураций атома марганца в следующих степенях окисления: 0, +2, +4, +6, +7.
2. Объясните эффект «провала» электрона в электронных конфигурациях меди и хрома.
3. Используя интернет-ресурсы, составьте таблицу атомных радиусов элементов 4-го периода и объясните характер их изменения.
4. Электроны какого энергетического уровня принято считать валентными у d-элементов?
5. Сравните электронное строение атомов элементов А- и В-групп:
- а) число валентных электронов;
- б) число валентных атомных орбиталей;
- в) максимальная степень окисления.
6. Почему у d-элементов по периоду свойства изменяются не так резко, как у s- и р-элементов?
7. Укажите взаимосвязь степени окисления d-элементов с их способностью образовывать катионные и анионные формы соединений?
8. Между хлором и марганцем в высшей степени окисления существует определённое сходство: в степени окисления +7 хлор и марганец образуют кислоты, одинаковые по составу: HClO4 и HMnO4 соответственно. Изобразите структурные формулы этих кислот.
9. Составьте уравнения реакций согласно схеме:
Cu → Cu(NO3)2 → CuS → Cu(NO3)2 → CuO → СH3CHO.
10. Через раствор сульфата меди(II) объёмом 1 дм3 с массовой долей соли 18 % (ρ = 1,2 г/см3) пропустили 23,3 дм3 сероводорода (н. у.). Определите массу осадка и массовые доли веществ в растворе.
Самоконтроль
1. Электронную конфигурацию валентного слоя d-элементов можно представить общей формулой:
- а) (n – 1)dxnsy;
- б) ndx(n − 1)sy;
- в) ndx;
- г) nsx.
2. Правильными являются утверждения:
- а) с ростом порядкового номера элемента в периоде высшая степень окисления возрастает от IIIВ-группы до первого элемента VIIIВ-группы, а затем убывает;
- б) высшая степень окисления у большинства d-элементов, как правило, соответствует номеру группы, к которой они относятся;
- в) в низких степенях окисления атомы d-элементов образуют химические связи, близкие к ионному типу;
- г) соединения элементов В-групп в высших степенях окисления проявляют сходство в свойствах с соединениями элементов в тех же степенях окисления А-групп.
3. Один s-электрон на внешнем слое в основном состоянии содержат атомы:
- а) V;
- б) Cr;
- в) Ni;
- г) Cu.
4. Электронная конфигурация атома железа:
- а) 3d64s2;
- б) 3d64s1;
- в) 3d54s2;
- г) 3d74s2.
5. Марганцу в высшей степени окисления соответствуют оба соединения в парах:
- а) Н2MnO4 и Мn2O7;
- б) KMnO4 и Мn2O7;
- в) NaMnO4 и HМnO4;
- г) KMnO4 и МnO2.