§ 48. Алюминий и его соединения
Алюминий как простое вещество
Физические свойства. Алюминий — серебристо-белый лёгкий металл с плотностью 2,7 г/см3, температурой плавления +660 °С и температурой кипения +2500 °С. Он очень пластичен, легко прокатывается в фольгу и протягивается в проволоку, хорошо проводит электрический ток.
Поверхность алюминия всегда покрыта тончайшей плотной плёнкой оксида Al2O3.

Процесс получения оксидных плёнок на поверхности металлов называется оксидированием. Образующиеся плёнки играют роль не только антикоррозионного покрытия, но и матрицы, в поры которой можно осадить красящее вещество для придания металлическим изделиям декоративных свойств. На рисунке показана лента из оксидированного алюминия, окрашенного в разные цвета.
Химические свойства. В ряду активности алюминий расположен сразу после щёлочноземельных металлов, что указывает на его высокую реакционную способность. Однако проявить эту активность при комнатной температуре во многих случаях ему мешает плотная плёнка оксида. Но при повышенной температуре она не препятствует протеканию большинства химических реакций. Ограничимся систематизацией известных вам превращений алюминия и его соединений и приведём краткие комментарии к некоторым из них (табл. 34).

Оксид алюминия выделяют из боксита — землистой глиноподобной массы, состоящей из гидроксида алюминия, оксидов железа и других металлов, а также оксида кремния (рис. 112.1).
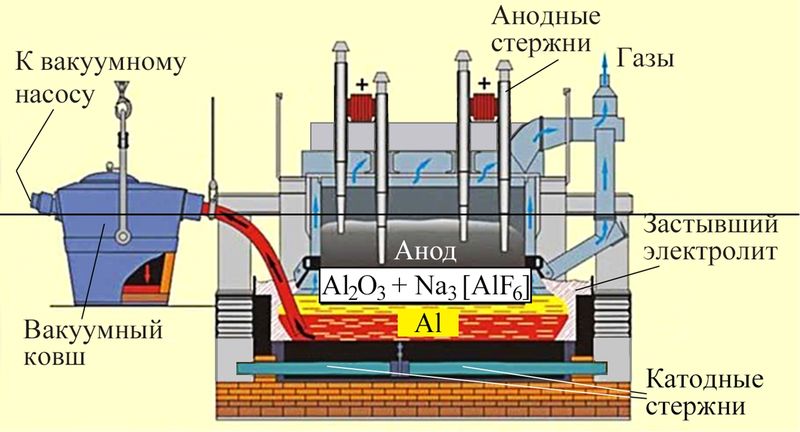
Электролизёр для получения алюминия представляет собой ванну, выложенную блоками из графита, к которой подведён электрический ток (рис. 112.2). В ванне при температуре при 950–970 °С находится расплав глинозёма с криолитом.
На катоде — графитовом блоке на дне ванны — при восстановлении катионов алюминия электрическим током выделяется жидкий алюминий, который периодически откачивают. На графитовом аноде выделяется кислород.
В токе выделяющегося кислорода анод частично обгорает с образованием СО и СО2, поэтому в промышленности для осуществления непрерывного процесса получения алюминия решают проблемы регенерирования анодов, подбора для них специальных материалов, обезвреживания выделяющихся газов.
В настоящее время решается вопрос о замене традиционной технологии производства алюминия на электролиз AlCl3, растворённого в расплаве солей KCl и NaCl. Это позволит сэкономить до 30 % энергии, снизить требования к сырью, заменить дорогостоящий криолит более дешёвыми солями, исключить выделение вредоносного фтора.
Способ получения металлического алюминия в лабораторных условиях был предложен в 1827 году Фридрихом Вёлером. Способ заключается в восстановлении алюминия из безводного AlCl3 калием при нагревании без доступа воздуха:
AlCl3 + 3K Al + 3KCl.
Таблица 34. Химические свойства алюминия
| Реагенты и уравнения реакций | Условия протекания и продукт реакции |
| Неметаллы | Al реагирует с сильными окислителями при комнатной температуре, с менее активными — при нагревании |
| Вода | Для проведения реакции с водой при комнатной температуре необходимо предварительно удалить оксидную плёнку |
| Кислоты | Al бурно реагирует с разбавленными кислотами. В концентрированных серной и азотной кислотах Al пассивируется |
| Щёлочи | При взаимодействии образуются водород и соли, содержащие гексагидроксоалюминат-ионы — комплексные анионы |
| Растворы солей | Процессы вытеснения менее активного металла алюминием протекают быстрее, если предварительно удалить плёнку Al2O3 |
| Оксиды некоторых металлов | Для инициирования реакции смесь реагентов необходимо разогреть. Далее процесс протекает самопроизвольно с выделением большого количества теплоты |
Получение алюминия. В промышленности алюминий получают электролизом расплава смеси глинозёма Al2О3 и криолита Na3[AlF6]:
.
Смесь оксида алюминия и криолита плавится при температуре более чем на 1000 °С ниже, чем чистый оксид. Это делает производство более безопасным, энергетически и экономически более выгодным.
Амальгированный алюминий можно получить, погружая металл на несколько секунд в раствор соли ртути(II).
Применение алюминия. Благодаря высокой электропроводности алюминия из него изготавливают электропровода. По сравнению с медными алюминиевые провода более лёгкие и дешёвые.
Из-за наличия на поверхности алюминия оксидной плёнки он не реагирует с водой, что позволяет изготавливать из алюминия кухонную посуду.
Широко применяются сплавы алюминия. С составом и применением дюралюминия вы уже ознакомились, изучая материал § 43, известны и другие сплавы. Авиаль — сплав алюминия с магнием и кремнием — используют для изготовления корпусов самолётов, кузовов автомобилей, корпусов мобильных телефонов. Сплав цинка с алюминием и медью — ЦАМ — применяют в автомобилестроении, для изготовления подшипников, разнообразной фурнитуры.
Ярко выраженные восстановительные свойства алюминия используются в алюмотермии для получения титана, бора, хрома и др., для сварки рельсов и деталей стального литья.

Для сварки массивных металлических деталей, например рельсов на трамвайных и железнодорожных путях, используют термит — смесь порошков Al и Fe3О4. При их взаимодействии выделяется огромное количество теплоты:
.
Температура повышается до 2 800 °С. Это вызывает плавление восстановленного железа, которое, стекая в стык рельсов, заполняет пространство между ними и сваривает их.