§ 48. Алюминий и его соединения
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 48. Алюминий и его соединения |
| Напечатано:: | Гость |
| Дата: | Tuesday, 14 October 2025, 23:55 |
Алюминий как химический элемент

Алюминий — элемент 3-го периода, IIIA-группы. Электронная схема, формула электронной конфигурации и электронно-графическая схема его атома имеют вид:
13Al ![]() или 13Аl 2е–, 8е–, 3е–;
или 13Аl 2е–, 8е–, 3е–;
13Аl 1s22s22p63s23p1 или 13Аl [Ne]3s23p1;
13Al 
На внешнем электронном слое у атомов алюминия имеется 3 электрона, конфигурация валентного слоя 3s23p1, то есть алюминий относится к р-элементам. Он имеет низкое значение электроотрицательности χ(Al) = 1,6 и проявляет в соединениях степень окисления только +3.
Алюминий — самый распространённый металл земной коры (ω(Al) = 7,5 %, (§ 43, рис. 102)). В природе он представлен единственным нуклидом .
Вследствие значительной химической активности алюминий в природных условиях находится преимущественно в виде химических соединений — минералов, представляющих собой оксиды, гидроксиды, силикаты или алюмосиликаты. Например, продукт разрушения горных пород — глина (каолинит), продукты дальнейшего разрушения глины — бокситы Al2O3 · xH2O. Наибольшее практическое значение для получения алюминия имеют бокситы и криолит Na3[AlF6].
Алюминий как простое вещество
Физические свойства. Алюминий — серебристо-белый лёгкий металл с плотностью 2,7 г/см3, температурой плавления +660 °С и температурой кипения +2500 °С. Он очень пластичен, легко прокатывается в фольгу и протягивается в проволоку, хорошо проводит электрический ток.
Поверхность алюминия всегда покрыта тончайшей плотной плёнкой оксида Al2O3.

Процесс получения оксидных плёнок на поверхности металлов называется оксидированием. Образующиеся плёнки играют роль не только антикоррозионного покрытия, но и матрицы, в поры которой можно осадить красящее вещество для придания металлическим изделиям декоративных свойств. На рисунке показана лента из оксидированного алюминия, окрашенного в разные цвета.
Химические свойства. В ряду активности алюминий расположен сразу после щёлочноземельных металлов, что указывает на его высокую реакционную способность. Однако проявить эту активность при комнатной температуре во многих случаях ему мешает плотная плёнка оксида. Но при повышенной температуре она не препятствует протеканию большинства химических реакций. Ограничимся систематизацией известных вам превращений алюминия и его соединений и приведём краткие комментарии к некоторым из них (табл. 34).

Оксид алюминия выделяют из боксита — землистой глиноподобной массы, состоящей из гидроксида алюминия, оксидов железа и других металлов, а также оксида кремния (рис. 112.1).
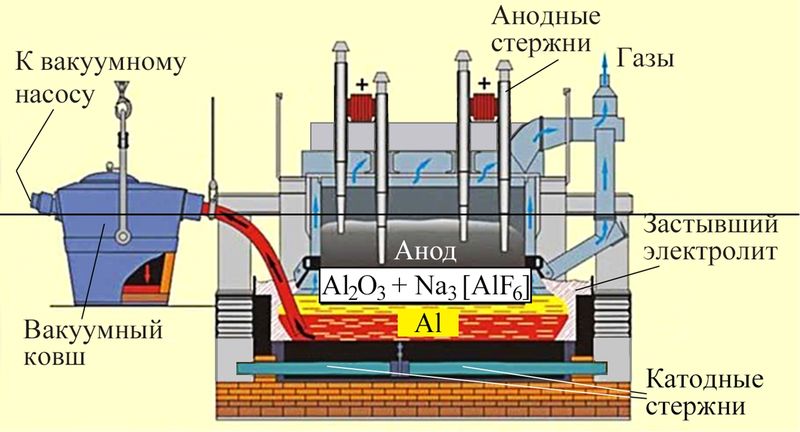
Электролизёр для получения алюминия представляет собой ванну, выложенную блоками из графита, к которой подведён электрический ток (рис. 112.2). В ванне при температуре при 950–970 °С находится расплав глинозёма с криолитом.
На катоде — графитовом блоке на дне ванны — при восстановлении катионов алюминия электрическим током выделяется жидкий алюминий, который периодически откачивают. На графитовом аноде выделяется кислород.
В токе выделяющегося кислорода анод частично обгорает с образованием СО и СО2, поэтому в промышленности для осуществления непрерывного процесса получения алюминия решают проблемы регенерирования анодов, подбора для них специальных материалов, обезвреживания выделяющихся газов.
В настоящее время решается вопрос о замене традиционной технологии производства алюминия на электролиз AlCl3, растворённого в расплаве солей KCl и NaCl. Это позволит сэкономить до 30 % энергии, снизить требования к сырью, заменить дорогостоящий криолит более дешёвыми солями, исключить выделение вредоносного фтора.
Способ получения металлического алюминия в лабораторных условиях был предложен в 1827 году Фридрихом Вёлером. Способ заключается в восстановлении алюминия из безводного AlCl3 калием при нагревании без доступа воздуха:
AlCl3 + 3K Al + 3KCl.
Таблица 34. Химические свойства алюминия
| Реагенты и уравнения реакций | Условия протекания и продукт реакции |
| Неметаллы | Al реагирует с сильными окислителями при комнатной температуре, с менее активными — при нагревании |
| Вода | Для проведения реакции с водой при комнатной температуре необходимо предварительно удалить оксидную плёнку |
| Кислоты | Al бурно реагирует с разбавленными кислотами. В концентрированных серной и азотной кислотах Al пассивируется |
| Щёлочи | При взаимодействии образуются водород и соли, содержащие гексагидроксоалюминат-ионы — комплексные анионы |
| Растворы солей | Процессы вытеснения менее активного металла алюминием протекают быстрее, если предварительно удалить плёнку Al2O3 |
| Оксиды некоторых металлов | Для инициирования реакции смесь реагентов необходимо разогреть. Далее процесс протекает самопроизвольно с выделением большого количества теплоты |
Получение алюминия. В промышленности алюминий получают электролизом расплава смеси глинозёма Al2О3 и криолита Na3[AlF6]:
.
Смесь оксида алюминия и криолита плавится при температуре более чем на 1000 °С ниже, чем чистый оксид. Это делает производство более безопасным, энергетически и экономически более выгодным.
Амальгированный алюминий можно получить, погружая металл на несколько секунд в раствор соли ртути(II).
Применение алюминия. Благодаря высокой электропроводности алюминия из него изготавливают электропровода. По сравнению с медными алюминиевые провода более лёгкие и дешёвые.
Из-за наличия на поверхности алюминия оксидной плёнки он не реагирует с водой, что позволяет изготавливать из алюминия кухонную посуду.
Широко применяются сплавы алюминия. С составом и применением дюралюминия вы уже ознакомились, изучая материал § 43, известны и другие сплавы. Авиаль — сплав алюминия с магнием и кремнием — используют для изготовления корпусов самолётов, кузовов автомобилей, корпусов мобильных телефонов. Сплав цинка с алюминием и медью — ЦАМ — применяют в автомобилестроении, для изготовления подшипников, разнообразной фурнитуры.
Ярко выраженные восстановительные свойства алюминия используются в алюмотермии для получения титана, бора, хрома и др., для сварки рельсов и деталей стального литья.

Для сварки массивных металлических деталей, например рельсов на трамвайных и железнодорожных путях, используют термит — смесь порошков Al и Fe3О4. При их взаимодействии выделяется огромное количество теплоты:
.
Температура повышается до 2 800 °С. Это вызывает плавление восстановленного железа, которое, стекая в стык рельсов, заполняет пространство между ними и сваривает их.
Соединения алюминия
Оксид алюминия Al2O3 — типичный амфотерный оксид, который реагирует как с кислотами, так и со щелочами:
Образованный в природных условиях оксид алюминия существует в виде корунда. По твёрдости он уступает только алмазу (Приложение 2). Прозрачные окрашенные кристаллы корунда относят к драгоценным камням — самоцветам: сапфир (Al2O3 с примесями титана, ванадия, железа) окрашен в синий цвет, рубин (Al2O3 с примесями хрома и железа) — в красный. Искусственно выращенные монокристаллы рубина используют в лазерах, часовой и ювелирной промышленности.
Порошок корунда Al2O3 благодаря его твёрдости применяют при шлифовании и полировании различных поверхностей. Твёрдый, тугоплавкий и химически инертный оксид алюминия является основным компонентом огнеупорных материалов — кирпичей, керамики, фарфора.
Гидроксид алюминия Al(ОН)3 — белый рыхлый порошок, который реагирует и с кислотами, и со щелочами (как в растворе, так и при сплавлении):
Таким образом, гидроксид алюминия обладает амфотерными свойствами.
При нагревании гидроксид алюминия разлагается на оксид и воду:
.
Он может быть получен в виде студенистого осадка при действии водного раствора аммиака на растворы солей алюминия:
.
В избытке аммиака осадок не растворяется. При использовании для его осаждения растворов NaОН и КОН избыток щелочей может привести к растворению образовавшегося осадка Аl(ОН)3. Поэтому, получая гидроксид алюминия в лаборатории, к раствору соли осторожно добавляют раствор щёлочи (но не наоборот!).
Растворимые соли алюминия частично реагируют с водой с образованием оснoвных солей и кислоты:
.
По причине взаимодействия солей алюминия с водой по обменной реакции в растворе нельзя получить нерастворимую соль алюминия и слабой кислоты (например, фторид, сульфид, карбонат алюминия).
Применение и биологическая роль соединений алюминия. Гидроксид алюминия применяют в качестве основы для обволакивающих и обезболивающих средств при лечении ожогов и желудочно-кишечных заболеваний. Алюмокалиевые квасцы — кристаллогидрат состава K2SO4 · Al2(SО4)3 · 24Н2О — используют в медицинской практике как кровоостанавливающее средство, в косметологии — в составе дезодорантов, в текстильной промышленности — для обработки тканей перед крашением, в кожевенной — при дублении кожи.
Избыточное поступление алюминия в организм человека может привести к хрупкости костей и нарушению памяти.
Алюминий — представитель р-элементов, активный металл, восстанавливает водород из воды, металлы из их оксидов.
Алюминий, его оксид Al2О3 и гидроксид Al(ОН)3 реагируют как с кислотами, так и со щелочами, то есть обладают амфотерными свойствами.
Вопросы, задания, задачи
1. Почему алюминий называют:
- а) «крылатым металлом»;
- б) «серебром из глины»?
2. Сравните электронное строение атома алюминия и его трёхзарядного катиона.
3. Составьте характеристику алюминия как химического элемента согласно плану, приведённому в § 12.
4. Составьте электронный баланс реакции взаимодействия алюминия с разбавленной азотной кислотой, уравнение которой приведено в тексте параграфа. Охарактеризуйте эту реакцию согласно плану, приведённому в § 18.
5. Рассчитайте объём водорода, выделившегося при взаимодействии алюминия массой 13,5 г с концентрированным раствором гидроксида натрия.
6. Методом электронного баланса расставьте коэффициенты в схемах реакций алюминия с концентрированными азотной и серной кислотами при нагревании:
7. К раствору нитрата алюминия добавили небольшое количество раствора гидроксида калия. Полученный осадок разделили на две части и растворили в серной кислоте и щёлочи (КОН) соответственно. Составьте уравнения протекавших реакций в молекулярной и ионной формах.
8. Алюмокалиевые квасцы K2SO4 · Al2(SО4)3 · 24Н2О массой 4,74 г растворили в воде (в мерной колбе) и объём довели до 200 см3. Рассчитайте молярную концентрацию ионов алюминия в растворе.
9. Алюминиевую пластинку погрузили в раствор, содержащий нитрат ртути(II) количеством 0,02 моль, и вынули после полного извлечения ртути из раствора. Определите:
- а) массу ртути, осевшей на поверхности пластинки;
- б) массу прореагировавшего алюминия;
- в) конечную массу пластинки, если исходная была равна 15,51 г.
10. Приведите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
- а)
;
- б)
.
Уравнения реакций, протекающих в растворах, представьте в молекулярной и ионной формах, укажите степени окисления атомов в окислительно-восстановительных реакциях.
*Самоконтроль
1. Атом алюминия в основном состоянии содержит:
- а) один р-электрон;
- б) семь р-электронов;
- в) два s-электрона;
- г) шесть s-электронов.
2. Алюминотермия — это:
- а) способ получения металлов;
- б) высокотемпературный процесс;
- в) способ получения зеркал с алюминиевым покрытием;
- г) промышленное получение алюминия.
3. Продуктом превращения Al(OH)3 + NaOH → является:
- а) NaAlO2;
- б) H2O;
- в) Na3[Al(OH)6];
- г) H2.
4. Оксид алюминия вступает в реакции с:
- а) HCl;
- б) H2O;
- в) KOH;
- г) H2.
5. При комнатной температуре алюминий не реагирует с:
- а) HNO3(разб);
- б) H2SO4(конц);
- в) HNO3(конц);
- г) HCl(конц).