§ 45. Общие способы получения металлов
Электрохимические методы
Электрохимический метод получения металлов (электрометаллургия) предполагает выделение металлов из руд электролизом. Электролиз — это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока, проходящего через раствор или расплав электролита. Его отличие от обычных окислительно-восстановительных реакций заключается в том, что процессы окисления и восстановления разделены в пространстве и протекают на электродах, помещённых в раствор или расплав электролита.
Процесс получения металлов электролизом проводят в аппаратах, называемых электролизёрами. В них имеется источник электрического питания, подсоединённый к электродам, которые погружены в ванну с токопроводящим водным раствором или расплавом соли металла.
Выбор условий проведения электролиза и состава электролита определяется положением металла в ряду активности. Электролизом водного раствора можно выделить только те металлы, которые находятся в ряду активности правее алюминия (например, Zn, Ni, Sn, Cr, Pb, Co, Cu, Ag, Au, Pd и др.). Алюминий, магний, щелочные и щёлочноземельные металлы, титан извлекают электролизом расплавов их оксидов или хлоридов.
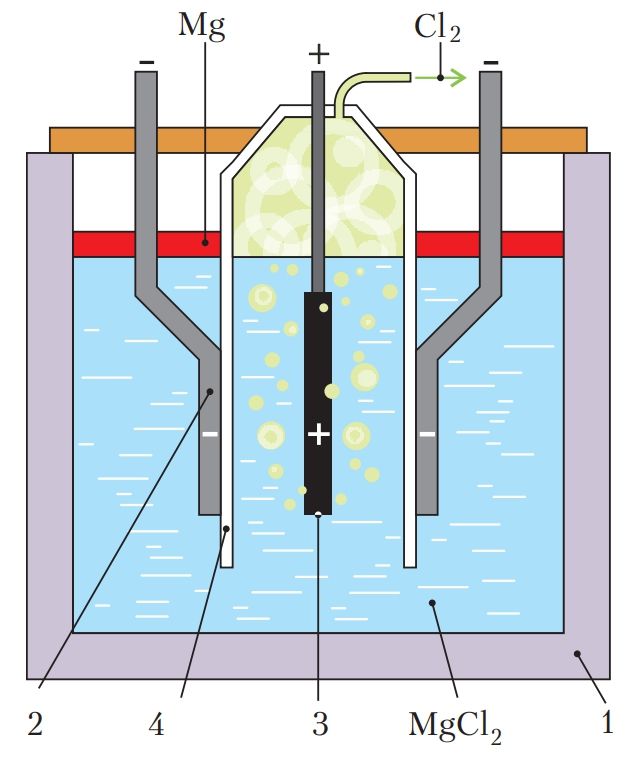
Рассмотрим процесс электролиза на примере получения магния из его хлорида (рис. 108).
Ванну электролизёра (1) заполняют расплавленным MgCl2. Для снижения его температуры плавления и повышения электропроводности расплава в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2. Температуру поддерживают в пределах 720 °С. В этих условиях хлорид магния и другие соли диссоциируют на ионы:
MgCl2 → Mg2+ + 2Cl–.
На катоде — электроде, подключённом к отрицательному полюсу источника постоянного тока (2), протекают процессы восстановления — передача электронов от катода катионам магния:
Mg2+ + 2e– = Mg0.
Другие металлы при заданных условиях электролиза не восстанавливаются, потому что концентрация их ионов мала.
Выделяющийся на катоде металлический магний всплывает в катодном пространстве на поверхность электролита, поскольку плотность магния меньше плотности электролита-расплава. Магний периодически удаляют с помощью вакуумного ковша.
На аноде — электроде, подключённом к положительному полюсу источника постоянного тока (3), протекают процессы окисления — электроны переходят от анионов к электроду:
2Cl– – 2e– = ↑.
Катодное и анодное пространство электролита разделено перегородкой (4), чтобы выделяющийся хлор не окислял магний и удалялся из электролизёра.