§ 45. Общие способы получения металлов
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 45. Общие способы получения металлов |
| Напечатано:: | Гость |
| Дата: | Monday, 20 October 2025, 07:47 |
Общие способы получения металлов
Значительная химическая активность металлов является причиной того, что в земной коре они существуют, как было отмечено ранее, преимущественно в виде соединений — минералов.
Горные породы (скопления минералов), из которых технологически возможно и экономически выгодно извлекать валовым способом металл, называют рудой. Руда практически никогда не содержит соединения металла в чистом виде, в ней всегда присутствуют примеси других минералов, которые называют пустой породой. Поэтому проблемой является не только разработка технологии извлечения металлов из минералов, но и поиск способов очистки минералов от пустой породы. Современные технологии делают экономически выгодным извлекать железо из руд, в которых его содержание составляет 30–55 %; цинк — 2–6 %; олово — 0,2–2 %; золото — 0,00002–0,0002 %.
Область науки и техники, отрасль промышленности, связанную с извлечением металлов из руд и получением их в виде, пригодном для использования, называют металлургией.
Металлургические процессы принято подразделять на три этапа.
Первый этап — предварительная обработка руды. На этом этапе производят обогащение руды — отделение всех ценных минералов от пустой породы. Если рудой являются сульфиды металла (CuFeS2, PbS, ZnS и др.), то такую руду предварительно обжигают в присутствии кислорода для перевода металлов в оксиды:
Второй этап — восстановление металлов из их соединений: оксидов или солей. Методы восстановления можно разделить на три большие группы: пирометаллургические, электрохимические и гидрометаллургические.
На третьем этапе проводят очистку металлов — рафинирование.
Метод получения металла из его руды выбирают с учётом свойств соединений металла и его химической активности.
Пирометаллургические методы
Пирометаллургические методы получения металлов основаны на восстановлении металлов из их руд при высокой температуре различными веществами с восстановительными свойствами. Наиболее распространённые восстановители — уголь, оксид углерода(II), водород, алюминий. В качестве примеров приведём используемые для получения металлов как в промышленности, так и в лаборатории реакции восстановления цинка углём и оксидом углерода(II), меди и вольфрама — водородом, железа и хрома — алюминием:
Рассмотрим более подробно процесс получения железа в составе его сплавов — чугуна и стали.
Основной источник железа — это руды, содержащие такие минералы, как магнетит (Fe3O4) и гематит (Fe2О3). Полезными примесями, улучшающими качество выплавляемого из руды железа, являются соединения Mn, Ni, Co, Сг, В, V. Их называют легирующими добавками. Соединения As, P, S, Pb, Zn — вредные примеси, ухудшающие свойства железа.
В настоящее время в производстве стали используют два основных способа.
Согласно первому традиционному способу получение стали проводят в две стадии. На первой из них получают чугун, который на второй стадии перерабатывают в сталь.


Для получения чугуна железо восстанавливают углеродом и угарным газом, который образуется при неполном сгорании угля. В доменную печь загружают смесь железной руды, специально обработанного угля, называемого коксом, и добавляют для понижения температуры плавления известняк. Такую смесь, называемую шихтой, вводят в доменную печь сверху, откуда она перемещается вниз в зону более высокотемпературного нагревания, где температура поднимается до 1600 °С и смесь расплавляется.
Вдуваемый снизу в доменную печь воздух обеспечивает горение углерода с выделением большого количества теплоты и образованием угарного газа, который восстанавливает железо из его оксидов. Восстановленное железо уже при температуре около 1000 °С науглероживается, и образуется сплав, называемый чугуном. В нём, помимо железа, содержатся графит и цементит — карбид железа Fe3C с суммарным содержанием углерода приблизительно от 2 до 6 %.
Расплав чугуна периодически отбирают, изолируя его от шлака. Химические процессы, протекающие в разных зонах доменной печи, представлены на рисунке.
При переработке чугуна в сталь на второй стадии процесса избыточный углерод, а нередко и другие примеси, например кремния, фосфора, серы, окисляют при высокой температуре кислородом воздуха. Для этого используют разные установки — мартеновские печи, конвертеры, электропечи. Образующиеся оксиды неметаллов всплывают в виде шлака или испаряются. Наряду с окислением примесей происходит также частичное окисление железа с образованием оксида железа(II), который растворяется в расплавах чугуна и стали. Оксид железа(II) восстанавливают, добавляя в расплав кремний, марганец или алюминий в качестве восстановителей. Образующийся шлак из оксидов отделяют от расплава железа.
Второй способ производства стали одностадийный, его называют прямым. В нём стадия получения чугуна отсутствует, меньше выброс углекислого газа в атмосферу. Являясь более экономичным, он постепенно вытесняет первый способ. Для получения стали железную руду измельчают, а затем обжигают с относительно небольшим количеством кокса во вращающихся печах. Полученные железорудные окатыши, содержащие оксиды железа, подвергают действию газообразного восстановителя в специальных реакторах.
В качестве восстановителя используют смесь метана, оксида углерода(II) и водорода. Водород и оксид углерода(II) образуются из метана при его окислении кислородом в присутствии катализатора в специальных аппаратах по реакции:
Образование металлического железа можно представить уравнениями реакций:
Полученное при восстановлении губчатое железо (окатыши) подвергают переплавлению в электродуговых печах. При этом, вводя необходимые добавки, железо легируют для получения того или иного сорта высококачественных сталей — коррозионностойких, инструментальных, конструкционных, электротехнических, жаропрочных и др.
Электрохимические методы
Электрохимический метод получения металлов (электрометаллургия) предполагает выделение металлов из руд электролизом. Электролиз — это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока, проходящего через раствор или расплав электролита. Его отличие от обычных окислительно-восстановительных реакций заключается в том, что процессы окисления и восстановления разделены в пространстве и протекают на электродах, помещённых в раствор или расплав электролита.
Процесс получения металлов электролизом проводят в аппаратах, называемых электролизёрами. В них имеется источник электрического питания, подсоединённый к электродам, которые погружены в ванну с токопроводящим водным раствором или расплавом соли металла.
Выбор условий проведения электролиза и состава электролита определяется положением металла в ряду активности. Электролизом водного раствора можно выделить только те металлы, которые находятся в ряду активности правее алюминия (например, Zn, Ni, Sn, Cr, Pb, Co, Cu, Ag, Au, Pd и др.). Алюминий, магний, щелочные и щёлочноземельные металлы, титан извлекают электролизом расплавов их оксидов или хлоридов.
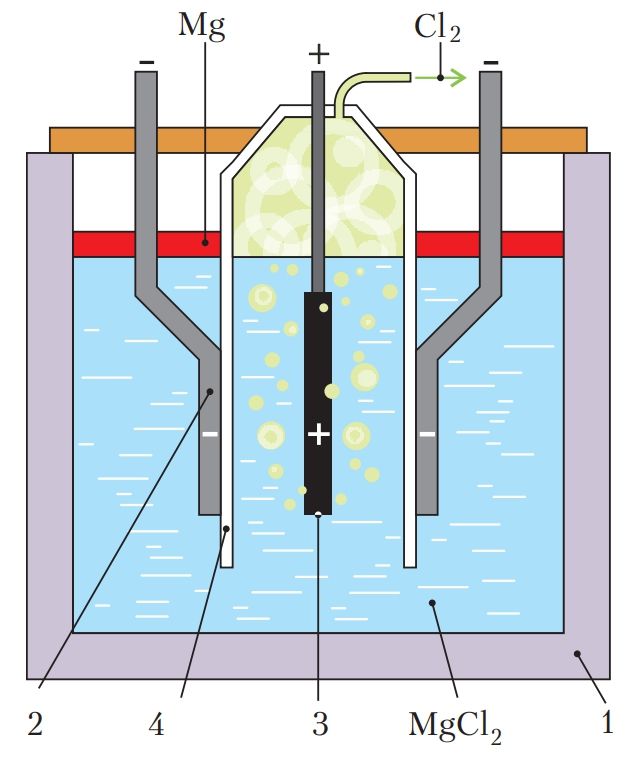
Рассмотрим процесс электролиза на примере получения магния из его хлорида (рис. 108).
Ванну электролизёра (1) заполняют расплавленным MgCl2. Для снижения его температуры плавления и повышения электропроводности расплава в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2. Температуру поддерживают в пределах 720 °С. В этих условиях хлорид магния и другие соли диссоциируют на ионы:
MgCl2 → Mg2+ + 2Cl–.
На катоде — электроде, подключённом к отрицательному полюсу источника постоянного тока (2), протекают процессы восстановления — передача электронов от катода катионам магния:
Mg2+ + 2e– = Mg0.
Другие металлы при заданных условиях электролиза не восстанавливаются, потому что концентрация их ионов мала.
Выделяющийся на катоде металлический магний всплывает в катодном пространстве на поверхность электролита, поскольку плотность магния меньше плотности электролита-расплава. Магний периодически удаляют с помощью вакуумного ковша.
На аноде — электроде, подключённом к положительному полюсу источника постоянного тока (3), протекают процессы окисления — электроны переходят от анионов к электроду:
2Cl– – 2e– = ↑.
Катодное и анодное пространство электролита разделено перегородкой (4), чтобы выделяющийся хлор не окислял магний и удалялся из электролизёра.
Гидрометаллургические методы
Гидрометаллургия — это выделение металлов из руд, концентратов и отходов производства с помощью водных растворов определённых веществ (химических реагентов).
Вначале металлы переводят в растворимые соединения. Затем их восстанавливают, используя либо химические реакции с сильными восстановителями, либо процессы вытеснения металлов из растворов их солей более активными металлами, либо электрохимическое восстановление из растворов.
Например, гидрометаллургическим методом извлекают медь из растворов её солей с помощью железа:
CuSO4 + Fe = Cu↓ + FeSO4.
Серебро и золото восстанавливают из растворов солей этих металлов цинком. Покрытия из никеля и цинка получают электролизом растворов их солей.
Процессы извлечения золота из обеднённых руд можно описать следующими уравнениями реакций:
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH;
2K[Au(CN)2] + Zn = K2[Zn(CN)4] + 2Au.
Предприятие «Унидрагмет БГУ» перерабатывает различный лом и отходы, содержащие драгоценные металлы (рис. 108.1), выделяя растворением их в смеси из 1 объёма азотной и 3 объёмов серной концентрированных кислот. Такую смесь называют «царской водкой». Растворение золота можно описать уравнением реакции
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O↑.
За 2000–2020 годы в Госфонд Республики Беларусь предприятием поставлено более 72 тонн золота, серебра, платины и других драгоценных металлов.

Металлургия — область науки и отрасль промышленности, связанная с извлечением металлов из руд и получением их в виде, пригодном для использования. Металлы получают восстановлением из их соединений:
- • методом пирометаллургии, используя в качестве восстановителей уголь, водород, оксид углерода(II), более активный металл (например, алюминий) при высокой температуре;
- • электрохимическим методом из растворов или из расплавов солей металлов, используя для восстановления электрический ток;
- • гидрометаллургическим методом восстановления металлов из растворов их солей более активными металлами.
- Электролиз — это окислительно-восстановительный процесс, протекающий на электродах под действием постоянного электрического тока, проходящего через раствор или расплав электролита.
Вопросы, задания, задачи
- Используя данные о температурах плавления металлов и сплавов (§ 43), предположите, почему первыми металлами, добытыми человеком, были золото, серебро, медь и только потом железо.
- Составьте уравнения реакций обжига сульфидных руд, содержащих минералы CuS, Cu2S, ZnS, FeS2.
-
Составьте уравнения реакций восстановления оксидов металлов Fe3O4, Fe2O3, FeO, PbO, ZnO оксидом углерода(II).

Микросхема - Составьте уравнения реакций выделения металлов алюмотермическим способом (восстановление алюминием) из их оксидов: МnO2, Cr2O3, Fe3O4.
- Рассчитайте и сравните массовую долю меди в минералах халькопирит СuFeS2 и малахит (CuOH)2CO3.
- Приведите уравнения реакций, протекающих на электродах в процессе получения натрия электролизом расплава его хлорида.
- В деталях мобильного телефона содержится около 0,050 г золота. Сколько нужно переработать телефонов, чтобы извлечь 1 кг золота? Выход продукта при переработке составляет 98 %.
- Составьте уравнения реакций согласно схеме:
где Х — сложное вещество, Y — простое вещество. - На территории нынешней Республики Беларусь в старину железо получали из болотной, озёрной и дерновой руды. Эта руда представляет собой бурый железняк, состоящий из гематита (Fe2O3) и лимонита (упрощённая формула FeOOH). Предложите способ, который мог быть использован в то время для получения железа.
- Вычислите массу чугуна с массовой долей железа 94 %, который можно получить из 10 тонн магнитного железняка с массовой долей Fe3O4 24 %.
*Самоконтроль
1. Верными являются утверждения:
- а) металлургия — это и область науки, и отрасль промышленности;
- б) обогащение руды — это отделение определённых минералов от пустой породы;
- в) при обжиге руды образуются, как правило, соли;
- г) наиболее распространённые в металлургии восстановители — С, СО, Н2, электрический ток.
2. Восстановление железа возможно в случае взаимодействия:
- а) Fe3O4 и HCl;
- б) Fe2O3 и C;
- в) FeO и H2;
- г) Fe2O3 и СаО.
3. При получении металлов электролизом катодными процессами являются:
- а) 2Сl– – 2e– = Cl2↑;
- б) Mg2+ + 2e– = Mg0;
- в) Na+ + e– = Na0;
- г) 4ОН– – 4e– = 2Н2О + О2↑.
4. К гидрометаллургическим методам получения металлов можно отнести процесс:
- а) СuSO4(р-р) + Fe →;
- б) Fe2O3 + Al →;
- в) FeO + CO →;
- г) NiCl2(р-р)
.
5. Массовая доля железа в чугуне составляет 94 %. Содержание углерода в нём:
- а) 7 %;
- б) 1,0–1,5 %;
- в) 6 %;
- г) менее 6 %.