§ 41. Элементы IVA-группы. Углерод и кремний
Оксиды углерода — углекислый и угарный газы
Особенности строения и физические свойства. Оксид углерода(IV), или углекислый газ , является высшим оксидом углерода и отвечает общей формуле ЭO2. Оксид углерода(IV) — вещество молекулярного строения. Молекула содержит две двойные ковалентные полярные связи, но линейна и поэтому неполярна (рис. 98, а).
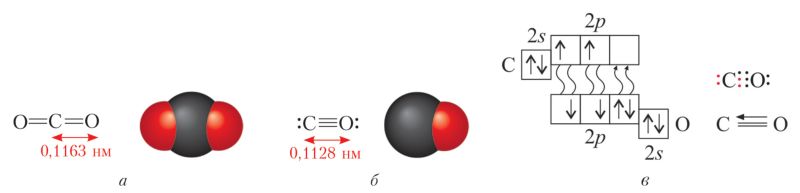
Вспомним, что углекислый газ бесцветен, тяжелее воздуха (М(CO2) = 44 г/моль), частично растворим в воде. В 1 объёме воды при температуре 20 °С растворяется 0,88 объёмов СО2, но при этом его растворимость в 70 раз выше растворимости кислорода и в 150 раз — азота. При повышенном давлении (5 МПа) он легко сжижается и затвердевает. Твёрдый оксид углерода(IV) — сухой лёд — возгоняется без плавления.
Второй оксид углерода(II) — угарный газ СО — также вещество молекулярного строения. Атомы в молекуле связаны очень прочной тройной ковалентной связью, связь полярная, молекула полярна (рис. 98, б). Газ бесцветен, плохо растворим в воде, ядовит.
Химические свойства оксида углерода(IV). Углекислый газ относится к кислотным оксидам, поэтому вступает в реакции с водой, щелочами и основными оксидами. С другой стороны, атомы углерода, имеющие степень окисления +4, могут участвовать в реакциях, которые протекают с понижением степени окисления: углекислый газ вступает в реакции с сильными восстановителями. Так, горящие магний или кальций продолжают гореть в атмосфере углекислого газа.
Реакции без изменения степени окисления
1. Реакция с водой. При пропускании углекислого газа через воду, в которую добавлен лакмус, окраска меняется с фиолетовой на красную — образуется угольная кислота:
.
2. Реакция с растворами щелочей приводит к образованию солей.
Как и в случае с сернистым газом, состав продуктов зависит от мольного соотношения реагентов.
Реакция углекислого газа с известковой водой наглядно демонстрирует последовательность образования солей при пропускании газа через раствор щёлочи. Вначале образуется осадок средней соли (качественная реакция на СО2, Приложение 3):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
При дальнейшем пропускании углекислого газа осадок растворяется вследствие образования более растворимой кислой соли:
СаСО3 + Н2О + СО2 = Са(НСО3)2.
3. С основными оксидами углекислый газ образует соли:
СаО + СO2 = СаСO3.
Реакции с изменением степени окисления — это, как было отмечено выше, реакции углекислого газа с восстановителями:
Химические свойства оксида углерода(II). Оксид углерода(II), или угарный газ СО, относят к несолеобразующим оксидам. С другой стороны, атом углерода, имея степень окисления +2, может её как повышать, так и понижать. При повышении степени окисления он проявляет свойства восстановителя. Такие процессы протекают при выплавке металлов:
,
при сгорании в кислороде:
.
Угарный газ не реагирует при комнатной температуре с раствором гидроксида натрия.
С расплавом этого гидроксида образует формиат натрия:
NaOH + СO HСООNa,
из которого действием серной кислоты получают муравьиную кислоту.
Реакция 2CO + O2 = 2CO2 начинается при температуре выше 500 °С, а в присутствии оксида марганца(IV) MnO2 как катализатора протекает уже при комнатной температуре.
Понижение степени окисления происходит в реакциях с восстановителями, а оксид углерода(II) при этом проявляет свойства окислителя. Пример такого превращения вам известен из курса органической химии: взаимодействие угарного газа с водородом (восстановителем) — важнейший способ получения спирта метанола:
.
Как углекислый, так и угарный газы загрязняют атмосферу. Напомним, что оксид углерода(II) не случайно называется угарным газом. Этот оксид очень ядовит. Образуясь при неполном сгорании топлива, он может привести к сильному отравлению или летальному исходу. Отсутствие запаха делает его ещё более опасным. Токсическое действие связано с тем, что молекулы угарного газа образуют прочное соединение с молекулами гемоглобина в крови. Таким образом они блокируют доступ кислорода, перекрывают клеточное дыхание.
Основной источник СО в атмосфере — выхлопные газы двигателей внутреннего сгорания, источник СО2 — топливно-энергетический комплекс и металлургическая промышленность. Накопление углекислого газа способствует глобальному потеплению на Земле («парниковый эффект»). Вспомним, что СО2 поглощается в процессе фотосинтеза. Поэтому вырубка лесов приводит к снижению поглощения углекислого газа зелёными растениями и негативно влияет на состояние атмосферы Земли.