§ 41. Элементы IVA-группы. Углерод и кремний
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 41. Элементы IVA-группы. Углерод и кремний |
| Напечатано:: | Гость |
| Дата: | Wednesday, 3 December 2025, 19:48 |
Углерод и кремний как химические элементы

Углерод 6С и кремний 14Si являются химическими элементами IVА-группы периодической системы, относятся к неметаллам. Кроме них группа включает также германий 32Ge, олово 50Sn, свинец 82Pb и флеровий 114Fl.
На внешнем электронном слое атомы содержат по 4 электрона, общая электронная конфигурация которого ns2np2:



Присоединяя электроны, атомы углерода и кремния проявляют отрицательную степень окисления ‒4, при потере электронов — +2 и +4.
При образовании химических связей атомов углерода с атомами других элементов полной отдачи или полного присоединения четырёх электронов не происходит, то есть формируются преимущественно ковалентные связи.
В отличие от других элементов IVА-группы число валентных электронов углерода равно числу валентных орбиталей. Это одна из причин большой устойчивости связи C—C и склонности атомов углерода соединяться друг с другом в цепи:
 ,
, и др.
и др.Распространённость в природе. Кремний — второй по распространённости на Земле элемент. Углерод, по большинству оценок, занимает 16-е место. Сведения о природных соединениях представлены в таблице 30.
Таблица 30. Химические элементы углерод и кремний
| Элемент | Радиус атома, нм | χ | Степени окисления | Природные соединения |
| Углерод 6С | 0,077 | 2,5 | –4, 0, +2, +4 | Простые вещества — алмаз, графит. Мел, мрамор, известняк, ракушечник, жемчуг, кальцит (СаСО3); углекислый газ, природный газ, нефть, органические вещества |
| Kремний 14Si | 0,117 | 1,9 | ‒4, 0, +2, +4 | Кремнезём, кварц, горный хрусталь (основной компонент SiО2); силикаты металлов |
Углерод и кремний как простые вещества. Углерод как простое вещество существует в виде нескольких аллотропных модификаций, важнейшие из которых — алмаз, графит, фуллерены. Кремний аллотропных модификаций не образует, существует в виде одного простого вещества с алмазоподобной структурой.
Кристаллические решётки аллотропных модификаций углерода приведены на рисунке 38. Из материала § 16 вы уже знаете, почему алмаз — самое твёрдое вещество, почему графит электропроводен и легко расслаивается. Вам также известно, что фуллерены состоят из сферических молекул С60, С80 (см. рис. 38).

Графен — аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом.
Материал, обладающий уникальными свойствами — высокой проводимостью и прочностью, гидрофобностью, особыми оптическими свойствами, — вызвал интерес не только учёных, но и технологов, связанных с производством процессоров.
Имеют большое значение и находят широкое применение аморфные формы углерода — древесный уголь, активированный уголь, сажа.
Кремний, в отличие от алмаза, является полупроводником, что позволяет его широко использовать в современных микросхемах. Его применяют также в производстве жаропрочных сталей.
Итак, особенности строения веществ определяют их свойства, а значит, и области использования.
Химические свойства
Углерод и кремний, как и подавляющее число других неметаллов, проявляют как окислительные (например, реагируя с металлами), так и восстановительные свойства (в реакциях с кислородом и фтором, некоторыми оксидами):
Также вспомним, что углерод вступает в реакцию с оксидом кальция:
,
а образующийся при этом карбид используют для получения ацетилена (например, для газовой сварки):
.
Второй важной реакцией, известной вам из курса химии 9-го класса, является взаимодействие углерода и кремния при высоких температурах:
.
Продукт реакции — карборунд SiC обладает высокой твёрдостью и термостойкостью, вследствие чего широко используется как абразивный и режущий материал, конструкционный материал в автомобилестроении, химической промышленности, ядерной энергетике. Полупроводниковые свойства обеспечивают его применение в электронике и электротехнике, оптические — в точной оптике и ювелирных изделиях (рис. 97.1).

В промышленных масштабах карборунд получают при температуре 1600−2500 °С, используя в качестве сырья оксид кремния(IV) и углерод:
SiO2 + 3C = SiC + 2CO↑.
Оксиды углерода — углекислый и угарный газы
Особенности строения и физические свойства. Оксид углерода(IV), или углекислый газ , является высшим оксидом углерода и отвечает общей формуле ЭO2. Оксид углерода(IV) — вещество молекулярного строения. Молекула содержит две двойные ковалентные полярные связи, но линейна и поэтому неполярна (рис. 98, а).
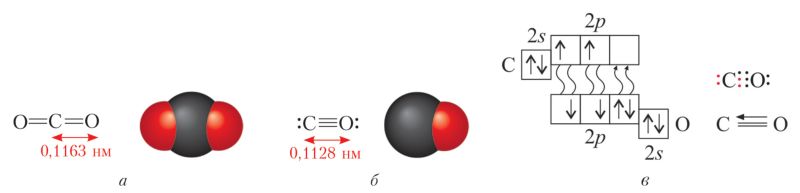
Вспомним, что углекислый газ бесцветен, тяжелее воздуха (М(CO2) = 44 г/моль), частично растворим в воде. В 1 объёме воды при температуре 20 °С растворяется 0,88 объёмов СО2, но при этом его растворимость в 70 раз выше растворимости кислорода и в 150 раз — азота. При повышенном давлении (5 МПа) он легко сжижается и затвердевает. Твёрдый оксид углерода(IV) — сухой лёд — возгоняется без плавления.
Второй оксид углерода(II) — угарный газ СО — также вещество молекулярного строения. Атомы в молекуле связаны очень прочной тройной ковалентной связью, связь полярная, молекула полярна (рис. 98, б). Газ бесцветен, плохо растворим в воде, ядовит.
Химические свойства оксида углерода(IV). Углекислый газ относится к кислотным оксидам, поэтому вступает в реакции с водой, щелочами и основными оксидами. С другой стороны, атомы углерода, имеющие степень окисления +4, могут участвовать в реакциях, которые протекают с понижением степени окисления: углекислый газ вступает в реакции с сильными восстановителями. Так, горящие магний или кальций продолжают гореть в атмосфере углекислого газа.
Реакции без изменения степени окисления
1. Реакция с водой. При пропускании углекислого газа через воду, в которую добавлен лакмус, окраска меняется с фиолетовой на красную — образуется угольная кислота:
.
2. Реакция с растворами щелочей приводит к образованию солей.
Как и в случае с сернистым газом, состав продуктов зависит от мольного соотношения реагентов.
Реакция углекислого газа с известковой водой наглядно демонстрирует последовательность образования солей при пропускании газа через раствор щёлочи. Вначале образуется осадок средней соли (качественная реакция на СО2, Приложение 3):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
При дальнейшем пропускании углекислого газа осадок растворяется вследствие образования более растворимой кислой соли:
СаСО3 + Н2О + СО2 = Са(НСО3)2.
3. С основными оксидами углекислый газ образует соли:
СаО + СO2 = СаСO3.
Реакции с изменением степени окисления — это, как было отмечено выше, реакции углекислого газа с восстановителями:
Химические свойства оксида углерода(II). Оксид углерода(II), или угарный газ СО, относят к несолеобразующим оксидам. С другой стороны, атом углерода, имея степень окисления +2, может её как повышать, так и понижать. При повышении степени окисления он проявляет свойства восстановителя. Такие процессы протекают при выплавке металлов:
,
при сгорании в кислороде:
.
Угарный газ не реагирует при комнатной температуре с раствором гидроксида натрия.
С расплавом этого гидроксида образует формиат натрия:
NaOH + СO HСООNa,
из которого действием серной кислоты получают муравьиную кислоту.
Реакция 2CO + O2 = 2CO2 начинается при температуре выше 500 °С, а в присутствии оксида марганца(IV) MnO2 как катализатора протекает уже при комнатной температуре.
Понижение степени окисления происходит в реакциях с восстановителями, а оксид углерода(II) при этом проявляет свойства окислителя. Пример такого превращения вам известен из курса органической химии: взаимодействие угарного газа с водородом (восстановителем) — важнейший способ получения спирта метанола:
.
Как углекислый, так и угарный газы загрязняют атмосферу. Напомним, что оксид углерода(II) не случайно называется угарным газом. Этот оксид очень ядовит. Образуясь при неполном сгорании топлива, он может привести к сильному отравлению или летальному исходу. Отсутствие запаха делает его ещё более опасным. Токсическое действие связано с тем, что молекулы угарного газа образуют прочное соединение с молекулами гемоглобина в крови. Таким образом они блокируют доступ кислорода, перекрывают клеточное дыхание.
Основной источник СО в атмосфере — выхлопные газы двигателей внутреннего сгорания, источник СО2 — топливно-энергетический комплекс и металлургическая промышленность. Накопление углекислого газа способствует глобальному потеплению на Земле («парниковый эффект»). Вспомним, что СО2 поглощается в процессе фотосинтеза. Поэтому вырубка лесов приводит к снижению поглощения углекислого газа зелёными растениями и негативно влияет на состояние атмосферы Земли.
Оксид кремния(IV)
Оксид кремния(IV) — вещество немолекулярного строения, в его кристаллах каждый атом кремния окружён четырьмя атомами кислорода (рис. 99). Он имеет довольно высокую твёрдость; широко распространен в природе (табл. 26, Приложение 2).

Химические свойства. Оксид кремния(IV) как кислотный оксид реагирует со щелочами и основными оксидами:
С водой оксид кремния(IV) не реагирует.
Имея высшую степень окисления, кремний в составе оксида может проявлять окислительные свойства. Так, процесс восстановления кремния(IV) углеродом используют для получения технического кремния в производстве полупроводниковых материалов:
Одно из значимых направлений применения оксида кремния(IV) — получение стекла спеканием песка SiО2, соды Na2CО3 и известняка СаСО3:
Углерод и кремний являются окислителями в реакциях с металлами, но восстановителями в реакциях с кислородом. Оксид углерода(IV) — кислотный оксид и окислитель. Оксид углерода(II) — несолеобразующий оксид и проявляет как окислительные, так и восстановительные свойства. Оксид кремния(IV) применяют в производстве стекла.
Вопросы, задания, задачи
1. Назовите аллотропные модификации углерода и области их использования. Прокомментируйте с химической точки зрения следующий текст: «Разнообразие его свойств поражает: самый мягкий и сверхтвёрдый, эталон прозрачности и абсолютной черноты, теплоизолятор и один из лучших проводников тепла, диэлектрик, проводник и полупроводник».
2. Составьте формулу электронной конфигурации и электронно-графическую схему кремния в основном и в одном из возбуждённых состояний.
3. Запишите для элементов с атомными номерами 6, 14, 32, 50 формулы:
- а) высших оксидов;
- б) летучих водородных соединений.
4. Составьте уравнения реакций:
- а) углерода с кислородом, водородом, бериллием (указывая степени окисления);
- б) углекислого газа с водой, оксидом бария, гидроксидом калия;
- в) оксида кремния(IV) с гидроксидом калия, оксидами кальция и бария.
5. Почему в атмосфере кислорода оксид углерода(IV) не горит, а оксид углерода(II) сгорает? Рассчитайте объём кислорода (н. у.), необходимый для сжигания угарного газа (н. у.) объёмом 15 м3.
6. По термохимическому уравнению вычислите количество теплоты, выделившейся при сгорании угарного газа объёмом 1 м3 (н. у.).
7. Предложите физический и химический способы разделения смеси оксидов углерода так, чтобы каждый из них был получен отдельно.

8. В сосуд, заполненный раствором гидроксида натрия, пропустили смесь угарного и углекислого газов. Почему наблюдается уменьшение размера пузырьков газа по мере их движения в растворе? Какое вещество собирается в пробирке над водным раствором? Какие вещества присутствуют в растворе?
9. Составьте уравнения реакций согласно схеме:
- а)
;
- б)
.
10. Углекислый газ объёмом 0,784 дм3 (н. у.) был полностью поглощён раствором, содержащим гидроксид натрия химическим количеством 0,04 моль. Определите массы полученных солей.
*Самоконтроль
1. Аллотропными модификациями углерода являются:
- а) сажа;
- б) графит;
- в) древесный уголь;
- г) алмаз.
2. Относительно кремния справедливы утверждения:
- а) существует в виде алмазоподобной кристаллической модификации;
- б) используется в качестве полупроводника;
- в) в карборунде SiC его атомы проявляют положительную степень окисления;
- г) первый по распространённости элемент в земной коре.
3. Угарный газ реагирует с:
- а) НСl;
- б) С;
- в) О2;
- г) Н2.
4. Поглотить углекислый газ можно, пропуская его через сосуд с:
- а) Р2О5;
- б) NaOH;
- в) СuSO4(безводный);
- г) Н2SO4(конц.).
5. Кислотные свойства углекислого газа характеризуют реакции, выражаемые уравнениями:
- а) СO2 + H2O
H2СO3;
- б) 2NaOH + СO2 = Na2СO3 + H2O;
- в) 6СО2 + 6Н2О = C6Н12O6 + 6O2 – Q;
- г) СO2 + 2Mg
C + 2MgO.