§ 36. Элементы VА-группы. Азот и фосфор
Азот как простое вещество
Азот как простое вещество состоит из двухатомных молекул N2, графическая формула молекулы азота . Атомы азота связаны между собой тремя ковалентными неполярными связями, причём одна из них — σ-связь и две π-связи (рис. 87).
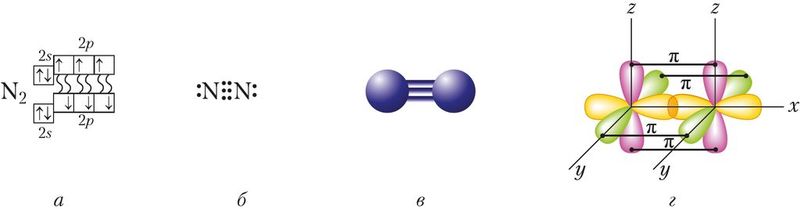
Энергия связи в молекуле азота очень высока и составляет 945 кДж/моль (для сравнения: О2 — 494 кДж/моль, Cl2 — 243 кДж/моль), что свидетельствует о прочности связей, а значит, и большой химической инертности вещества. Действительно, в подавляющем большинстве реакции с участием азота протекают в «жёстких условиях» (при очень высоких температурах и давлениях).
Физические свойства. Небольшое значение относительной молекулярной массы (Мr(N2) = 28) и отсутствие полярности у молекул азота определяют низкие температуры кипения и плавления –196 °С и –210 °С. Азот — газ (н. у.) без цвета и запаха, почти не растворяется в воде.
Химические свойства. Азот в реакциях с кислородом и фтором проявляет свойства восстановителя, а с металлами и водородом — окислителя.
1. Азот как восстановитель. Реакция азота с кислородом протекает при температуре около 3000 °С — в электрической дуге или разряде молнии. Реакция является эндотермической. При этом образуется оксид азота(II):
2. Азот как окислитель. Реакция азота с водородом протекает при высокой температуре и давлении даже в присутствии катализаторов:
Реагируя с металлами (при повышенной температуре), азот образует бинарные соединения нитриды:
(нитрид магния).
С литием азот вступает в реакцию без нагревания:
(нитрид лития).
Нитриды легко разлагаются водой, образуя аммиак и гидроксиды металлов:
Азот получают в промышленных масштабах из сжиженного воздуха, в лаборатории в небольших количествах — разложением нитрита аммония:
Применение. Основная область применения азота — производство аммиака. Его используют также для создания инертной среды при хранении пищевых продуктов, произведений искусства и рукописей, в пожаротушении, лазерной резке металлов. Расширяется спектр его применения в медицине и косметологии, например криоконсервация клеток, криотерапия (удаление папиллом и гемангиом).