§ 36. Элементы VА-группы. Азот и фосфор
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 36. Элементы VА-группы. Азот и фосфор |
| Напечатано:: | Гость |
| Дата: | Saturday, 1 November 2025, 15:17 |
Азот и фосфор как химические элементы

Элементы VА-группы азот 7N и фосфор 15Р образуют простые вещества, относящиеся к неметаллам. К этой же группе периодической системы относят мышьяк 33As, сурьму 51Sb и висмут 83Bi. На внешнем электронном слое, общая конфигурация которого ns2np3, их атомы имеют по 5 электронов, из которых три неспаренных на р-подуровне:
Низшая степень их окисления равна ‒3, высшая +5, при этом фосфор чаще всего проявляет положительные степени окисления +3 и +5, а азот образует достаточно устойчивые соединения со степенями окисления +1, +2, +3, +4 и +5. Азот — третий по электроотрицательности элемент после кислорода и фтора, а фосфор незначительно уступает водороду (см. § 11, табл. 7, с. 60).
Распространённость азота и фосфора в природе
Среди элементов VА-группы на Земле наиболее распространён фосфор, его массовая доля — 0,1 %. Азота гораздо меньше, но он преобладает в атмосфере — объёмная доля 78 %, массовая — 75,5 %. Из немногочисленных минералов азота наиболее значимы селитры: NaNO3 — натриевая селитра и KNO3 — калийная селитра.
Фосфор на Земле встречается исключительно в виде соединений и входит в состав фосфоритов и апатитов (их основной компонент — фосфат кальция Ca3(PO4)2), а также фторапатитов Са5[РО4]3F.
Соединения азота и фосфора важны для живых организмов: азот как составная часть аминокислот и белков, фосфор — нуклеиновых кислот, АТФ (аденозинтрифосфорной кислоты), ферментов, костной системы. Для человека суточная потребность в фосфоре достаточно высока — от 1 г до 3,8 г в зависимости от возраста и физиологического состояния организма. При нагрузках потребность возрастает в 1,5–2 раза. Наиболее богаты фосфором ядра семян тыквы, подсолнечника, а также какао, печень, рыба, твёрдые сыры и другие молочные продукты. Недостаток в азоте и фосфоре зачастую испытывают растения. Для возделываемых культур эта проблема решается внесением удобрений.
Азот как простое вещество
Азот как простое вещество состоит из двухатомных молекул N2, графическая формула молекулы азота . Атомы азота связаны между собой тремя ковалентными неполярными связями, причём одна из них — σ-связь и две π-связи (рис. 87).

Энергия связи в молекуле азота очень высока и составляет 945 кДж/моль (для сравнения: О2 — 494 кДж/моль, Cl2 — 243 кДж/моль), что свидетельствует о прочности связей, а значит, и большой химической инертности вещества. Действительно, в подавляющем большинстве реакции с участием азота протекают в «жёстких условиях» (при очень высоких температурах и давлениях).
Физические свойства. Небольшое значение относительной молекулярной массы (Мr(N2) = 28) и отсутствие полярности у молекул азота определяют низкие температуры кипения и плавления –196 °С и –210 °С. Азот — газ (н. у.) без цвета и запаха, почти не растворяется в воде.
Химические свойства. Азот в реакциях с кислородом и фтором проявляет свойства восстановителя, а с металлами и водородом — окислителя.
1. Азот как восстановитель. Реакция азота с кислородом протекает при температуре около 3000 °С — в электрической дуге или разряде молнии. Реакция является эндотермической. При этом образуется оксид азота(II):
2. Азот как окислитель. Реакция азота с водородом протекает при высокой температуре и давлении даже в присутствии катализаторов:
Реагируя с металлами (при повышенной температуре), азот образует бинарные соединения нитриды:
(нитрид магния).
С литием азот вступает в реакцию без нагревания:
(нитрид лития).
Нитриды легко разлагаются водой, образуя аммиак и гидроксиды металлов:
Азот получают в промышленных масштабах из сжиженного воздуха, в лаборатории в небольших количествах — разложением нитрита аммония:
Применение. Основная область применения азота — производство аммиака. Его используют также для создания инертной среды при хранении пищевых продуктов, произведений искусства и рукописей, в пожаротушении, лазерной резке металлов. Расширяется спектр его применения в медицине и косметологии, например криоконсервация клеток, криотерапия (удаление папиллом и гемангиом).
Фосфор как простое вещество
Фосфор, являясь элементом VА-группы, как и азот, способен образовывать молекулу состава P2. Однако, в отличие от молекулы азота, двухатомная молекула фосфора неустойчива. Поэтому фосфор существует в виде нескольких аллотропных модификаций, в которых реализуются лишь одинарные связи Р—Р: фосфор белый, красный, чёрный и другие (табл. 29).
Таблица 29. Строение и физические свойства аллотропных модификаций фосфора
| Аллотропные модификации фосфора | Строение | Температура плавления | Температура кипения |
|
Р4 фосфор белый  |
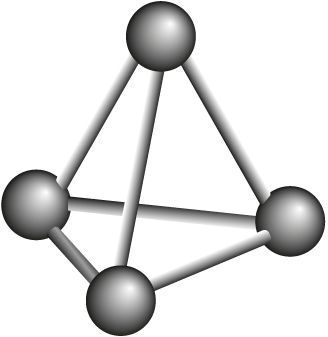 |
44 °С | 281 °С |
|
Р фосфор красный  |
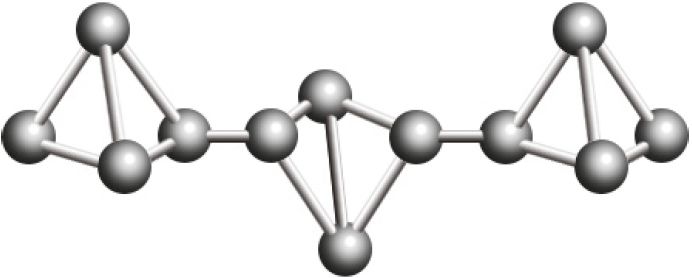 |
260 °С | ‒ Возгоняется при температуре около 400 °С |
|
* Р фосфор чёрный  |
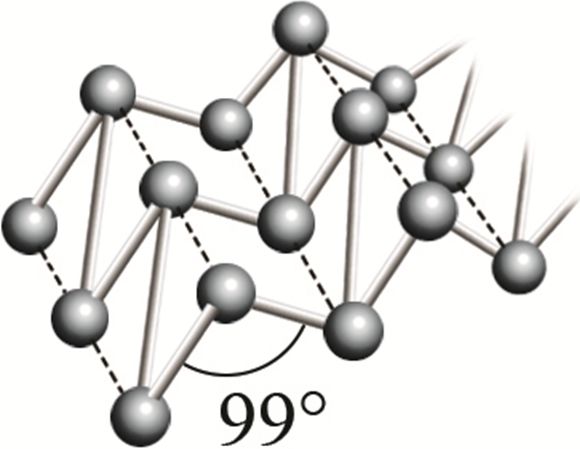
Фрагмент кристаллической решётки чёрного фосфора |
При нагревании (атмосферное давление) превращается в красный фосфор | 1000 °С (при 1,8 ∙ 106 атм) |

Физические свойства. Белый фосфор Р4 представляет собой воскообразное вещество с чесночным запахом, ядовит. На воздухе в темноте светится зеленовато-жёлтым цветом в результате медленной химической реакции окисления (хемилюминесценция (рис. 88)).
Красный фосфор — аморфное вещество полимерного строения, не имеет запаха, его токсичность невысокая.
Между аллотропными модификациями фосфора возможны взаимопревращения, протекающие при определённых температурах и давлениях.
Химические свойства. Как окислитель фосфор при нагревании вступает в реакции с металлами, образуя фосфиды:
С водородом фосфор не реагирует.
Как восстановитель фосфор реагирует с кислородом и другими сильными окислителями. В чистом кислороде и на воздухе фосфор ослепительно горит, образуя белый дым (частицы твёрдых оксидов фосфора):
(оксид фосфора(V) в избытке кислорода);
(оксид фосфора(III) при недостатке кислорода).
Белый фосфор может самовоспламеняться на воздухе, а красный загорается лишь при поджигании, что объясняется различной прочностью химических связей между атомами фосфора в аллотропных модификациях.
Фосфор получают прокаливанием смеси фосфата кальция с песком и углём:
Не реагируя с водородом непосредственно, фосфор тем не менее образует водородные соединения. Так, фосфин можно получить косвенно, например, из фосфидов, которые разрушаются как водой, так и кислотами: Mg3Р2 + 6H2O = 3Mg(ОН)2↓ + 2РH3↑.
Фосфин РH3 — газ с чесночным запахом.
В природе водородные соединения фосфора встречаются там, где происходит интенсивное разложение белковых веществ.
Применение. Белый фосфор используют для производства фосфорных кислот и их производных, в металлургии как компонент некоторых жаропрочных сплавов. Красный фосфор применяют в производстве спичек, в органическом синтезе (лекарственные препараты, ядохимикаты). Образцы фосфора, содержащие нуклид 32Р («меченый атом») с периодом полураспада 14,22 суток, используют в исследовательских работах.
Низшая степень окисления азота и фосфора –3, высшая +5.
Инертность простого вещества азот обусловлена наличием тройной связи в молекуле N2.
Фосфор существует в виде нескольких аллотропных модификаций: белый, красный и другие.
Азот и фосфор проявляют как восстановительные, так и окислительные свойства. Фосфор не реагирует с водородом.
Вопросы, задания, задачи
1. Назовите:
- а) формулу простого вещества азот;
- б) формулу белого фосфора;
- в) низшую степень окисления азота;
- г) высшую степень окисления фосфора;
- д) особенности запаха белого фосфора;
- е) аллотропную модификацию фосфора, используемого в производстве спичек;
- ж) природные соединения фосфора;
- з) химические формулы калиевой селитры, натриевой селитры;
- и) содержание азота в воздухе.
2. Запишите символы элементов VA-группы и общую формулу их электронной конфигурации.
3. Охарактеризуйте электронное строение атомов азота и фосфора.
4. Опишите физические свойства азота и аллотропных модификаций фосфора.
5. Заполните таблицу для реагентов кислород, водород, литий, магний (впишите в своей тетради соответствующие уравнения возможных реакций).
| Реагент | N2 | P |
Сделайте выводы о сходстве и различии свойств азота и фосфора.
6. При взаимодействии кальция массой 0,9 г с азотом получено соединение массой 1,11 г. Установите химическую формулу соединения.
7. Фосфор окисляется хлором, азотной и серной кислотами. Расставьте коэффициенты методом электронного баланса в схемах этих реакций:
- а) Р + Сl2 → PCl5;
- б) Р + КСlO3 → P2O5 + KCl;
- в) Р + HNO3(разб) + H2О → H3PO4 + NO;
- г) Р + H2SO4(конц) → H3PO4 + SO2 + H2О.
8. Рассчитайте массу белого фосфора, который можно получить при прокаливании с песком и углём фосфорита, содержащего фосфат кальция массой 6,2 т, если выход продукта составляет 92 %. Реакция протекает согласно уравнению на с. 201.
9. Как влияет повышение температуры и давления на смещение равновесия в реакциях:
- а)
;
- б)
?
10. В замкнутый сосуд поместили водород химическим количеством 6 моль и азот количеством 4 моль и нагрели до 450 °С в присутствии катализатора. Определите объёмную долю аммиака в конечной смеси, если доля вступившего в реакцию азота равна 15 %.
*Самоконтроль
1. Тройную связь содержит молекула:
- а) Н2;
- б) N2;
- в) Р4;
- г) О2.
2. Фосфор как элемент характеризуют утверждения:
- а) входит в состав костной ткани преимущественно в виде фосфата кальция;
- б) высшая степень окисления равна +5;
- в) красный фосфор является компонентом покрытия на спичечных коробках;
- г) белый фосфор имеет молекулярное строение.
3. Фосфор не реагирует даже при нагревании с:
- а) Мg;
- б) Zn;
- в) О2;
- г) Н2.
4. Азот имеет положительную степень окисления в соединениях:
- а) NO;
- б) NaNO3;
- в) КNO3;
- г) Na3N.
5. Фосфор выступает в роли окислителя, реагируя с:
- а) Na;
- б) Zn;
- в) Са;
- г) Cl2.