§ 34. Кислородные соединения серы
Оксид серы(IV)
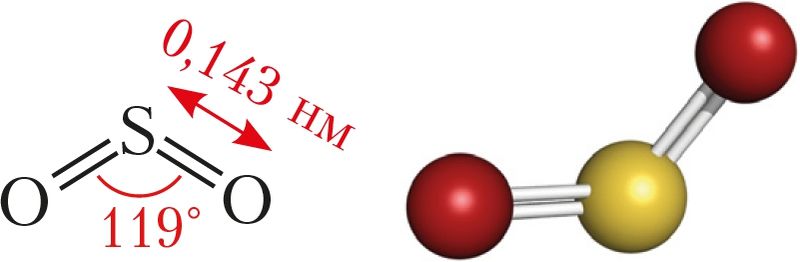
Оксид серы(IV) — вещество молекулярного строения (рис. 79).
Физические свойства. Оксид серы(IV) при нормальных условиях представляет собой бесцветный газ с характерным резким запахом — запахом загорающейся спички. Газ токсичен. В одном объёме воды растворяется около 40 объёмов газа при 20 °С, что гораздо ниже, чем в случае хлороводорода и аммиака.

Температура его кипения намного выше, чем у кислорода, и равна –10 °С. Газ легко сжижается при комнатной температуре уже при небольшом давлении, что позволяет хранить и транспортировать сжиженный газ в баллонах (рис. 80).
Химические свойства. В химических реакциях, протекающих без изменения степени окисления, оксид серы(IV) должен проявлять свойства кислотного оксида: с водой он должен образовывать кислоту, со щелочами и основными оксидами — соли. Поскольку низшая степень окисления серы равна –2, а высшая +6, следует предположить, что для сернистого газа характерны реакции как с повышением степени окисления серы, так и с её понижением.
При повышении степени окисления атомы серы «теряют» электроны. Это означает, что оксид проявляет свойства восстановителя, то есть реагирует с окислителями, например с кислородом, хлором. Понижая степень окисления, атомы серы присоединяют электроны, а сернистый газ выступает в роли окислителя. Это происходит при взаимодействии с сильными восстановителями, например, СО, РН3.
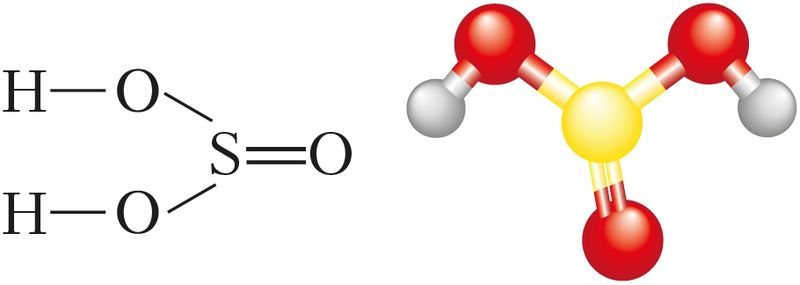
Прокомментируем выше сказанное и поясним уравнениями химических реакций.
I. Реакции без изменения степени окисления.
1. Реакция с водой. При пропускании сернистого газа через воду, в которую добавлен лакмус, окраска меняется от фиолетовой до красной — образуется сернистая кислота:
Структурная формула сернистой кислоты изображена на рисунке 81.

Сернистая кислота является слабой. Как двухосновная кислота она диссоциирует ступенчато:
Это также означает, что сернистая кислота образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
2. Реакция с растворами щелочей приводит к образованию солей. Состав продуктов зависит от мольного соотношения реагентов:
2 : 1 или избыток щёлочи |
(сульфит натрия) |
1 : 1 или избыток кислотного оксида |
(гидросульфит натрия) |
3. С основными оксидами сернистый газ также образует соли:
СаО + SO2 = СаSO3.
II. Реакции с изменением степени окисления.
Реакции с окислителями. Взаимодействие с кислородом приводит к образованию оксида серы(VI):
,
что свидетельствует о восстановительных свойствах оксида серы(IV).
Реакция обратимая, протекает со значительной скоростью лишь при повышенной температуре (более 440 °С) в присутствии катализаторов (например, V2O5).
Реакции с восстановителями. Примером такой реакции может служить утилизация сернистого газа углеродом. Так получают серу из отходящих газов в металлургической промышленности:
Применение оксида серы(IV). Сернистый газ в промышленных масштабах является промежуточным продуктом при получении серной кислоты. Как пищевая добавка (Е220) он используется в пищевой промышленности в качестве консерванта. Им окуривают хранилища овощей, плодов и фруктов для обеззараживания. Его применяют для отбеливания шёлка и шерсти, так как хлор в данном случае использовать нельзя.
Сернистый газ образуется при сжигании серы и обжиге сульфидов металлов (например, пирита, сульфида цинка).
Оксид серы(IV) в лаборатории получают действием серной кислоты на сульфиты или медь:
Следует отметить, что сернистый газ — один из загрязнителей атмосферы. Его источником являются предприятия чёрной и цветной металлургии, теплоэлектростанции.