§ 34. Кислородные соединения серы
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 34. Кислородные соединения серы |
| Напечатано:: | Гость |
| Дата: | Вторник, 26 Август 2025, 08:03 |
Сера, проявляя степени окисления +4 и +6, образует два устойчивых оксида состава — оксид серы(IV), или сернистый газ, и
— оксид серы(VI).
Оксид серы(IV)
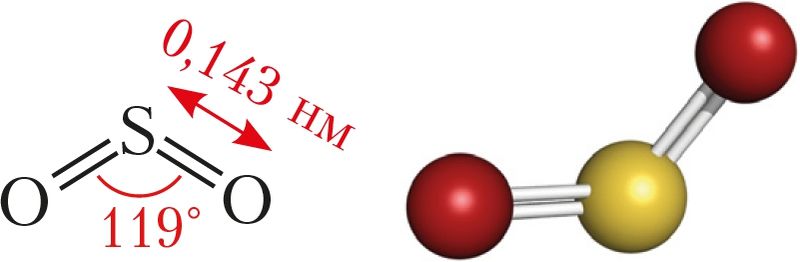
Оксид серы(IV) — вещество молекулярного строения (рис. 79).
Физические свойства. Оксид серы(IV) при нормальных условиях представляет собой бесцветный газ с характерным резким запахом — запахом загорающейся спички. Газ токсичен. В одном объёме воды растворяется около 40 объёмов газа при 20 °С, что гораздо ниже, чем в случае хлороводорода и аммиака.

Температура его кипения намного выше, чем у кислорода, и равна –10 °С. Газ легко сжижается при комнатной температуре уже при небольшом давлении, что позволяет хранить и транспортировать сжиженный газ в баллонах (рис. 80).
Химические свойства. В химических реакциях, протекающих без изменения степени окисления, оксид серы(IV) должен проявлять свойства кислотного оксида: с водой он должен образовывать кислоту, со щелочами и основными оксидами — соли. Поскольку низшая степень окисления серы равна –2, а высшая +6, следует предположить, что для сернистого газа характерны реакции как с повышением степени окисления серы, так и с её понижением.
При повышении степени окисления атомы серы «теряют» электроны. Это означает, что оксид проявляет свойства восстановителя, то есть реагирует с окислителями, например с кислородом, хлором. Понижая степень окисления, атомы серы присоединяют электроны, а сернистый газ выступает в роли окислителя. Это происходит при взаимодействии с сильными восстановителями, например, СО, РН3.
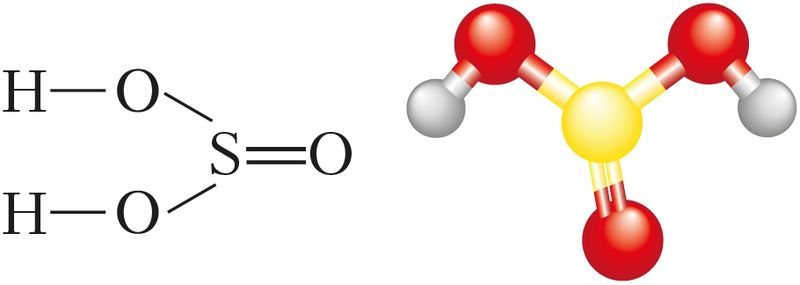
Прокомментируем выше сказанное и поясним уравнениями химических реакций.
I. Реакции без изменения степени окисления.
1. Реакция с водой. При пропускании сернистого газа через воду, в которую добавлен лакмус, окраска меняется от фиолетовой до красной — образуется сернистая кислота:
Структурная формула сернистой кислоты изображена на рисунке 81.

Сернистая кислота является слабой. Как двухосновная кислота она диссоциирует ступенчато:
Это также означает, что сернистая кислота образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
2. Реакция с растворами щелочей приводит к образованию солей. Состав продуктов зависит от мольного соотношения реагентов:
2 : 1 или избыток щёлочи |
(сульфит натрия) |
1 : 1 или избыток кислотного оксида |
(гидросульфит натрия) |
3. С основными оксидами сернистый газ также образует соли:
СаО + SO2 = СаSO3.
II. Реакции с изменением степени окисления.
Реакции с окислителями. Взаимодействие с кислородом приводит к образованию оксида серы(VI):
,
что свидетельствует о восстановительных свойствах оксида серы(IV).
Реакция обратимая, протекает со значительной скоростью лишь при повышенной температуре (более 440 °С) в присутствии катализаторов (например, V2O5).
Реакции с восстановителями. Примером такой реакции может служить утилизация сернистого газа углеродом. Так получают серу из отходящих газов в металлургической промышленности:
Применение оксида серы(IV). Сернистый газ в промышленных масштабах является промежуточным продуктом при получении серной кислоты. Как пищевая добавка (Е220) он используется в пищевой промышленности в качестве консерванта. Им окуривают хранилища овощей, плодов и фруктов для обеззараживания. Его применяют для отбеливания шёлка и шерсти, так как хлор в данном случае использовать нельзя.
Сернистый газ образуется при сжигании серы и обжиге сульфидов металлов (например, пирита, сульфида цинка).
Оксид серы(IV) в лаборатории получают действием серной кислоты на сульфиты или медь:
Следует отметить, что сернистый газ — один из загрязнителей атмосферы. Его источником являются предприятия чёрной и цветной металлургии, теплоэлектростанции.
Оксид серы(VI)
Оксид серы(VI) — высший оксид серы (рис. 82).
Оксид серы(VI) образуется при окислении сернистого газа кислородом или озоном:

Физические свойства. Оксид серы(VI) является бесцветной жидкостью в узком интервале температур: от 16,9 °С до 44,9 °С. Обладает удушающим запахом. При попадании на кожу вызывает тяжёлые ожоги.
Химические свойства. — типичный кислотный оксид и сильный окислитель. Как кислотный оксид реагирует с водой, образуя серную кислоту:
В реакциях со щелочами и основными оксидами образует соли:
Особым свойством оксида серы(VI) является его способность растворяться в серной кислоте.
Такой раствор называют олеумом. Он представляет собой дымящую на воздухе бесцветную маслянистую вязкую жидкость или даже кристаллы.
Олеум перевозят в стальных цистернах. Из него разбавлением получают серную кислоту нужной концентрации. При этом первоначально разбавляют серной кислотой, так как при вливании олеума в воду происходит вскипание, в результате чего образуется ядовитый сернокислотный туман.
В составе олеума, помимо серной кислоты, содержатся и другие кислоты серы(VI), например дисерная (или пиросерная):
SO3 + H2SO4 = H2S2O7.
Как окислитель SO3 реагирует с восстановителями. Атомы серы в составе оксида имеют высшую степень окисления +6 и могут её только понижать, принимая электроны от восстановителей. Примером окислительных свойств оксида серы(VI) может служить реакция с фосфором как восстановителем:
Важнейшими кислородными соединениями серы являются два кислотных оксида — оксид серы(IV), или сернистый газ SO2, и оксид серы(VI) SO3. Как кислотные оксиды они образуют кислоты при взаимодействии с водой и соли в реакциях со щелочами и основными оксидами.
Оксид серы(IV) проявляет и окислительные, и восстановительные свойства, а оксид серы(VI)
— только окислительные.
Вопросы, задания, задачи
1. Запишите формулы оксидов серы и соответствующих им кислот, укажите их названия.
2. Назовите области использования сернистого газа.
3. В колбу с дистиллированной водой непродолжительное время пропускали сернистый газ, а затем добавили несколько капель индикатора. Назовите окраску содержимого колбы, если этим индикатором был:
- а) лакмус;
- б) метилоранж;
- в) фенолфталеин.
4. Для сернистого газа рассчитайте:
- а) плотность при н. у. по формуле
;
- б) относительную плотность по водороду;
- в) относительную плотность по воздуху.
5. Заполните таблицу «Химические свойства оксидов серы» соответствующими уравнениями реакций для реагентов Н2О, КОН, CaO, O2.
| Реагенты | Оксид серы(IV) | Оксид серы(VI) |
Сделайте вывод о сходстве и различии химических свойств указанных оксидов серы.
6. Рассчитайте, чему равен объём (н. у.) оксида серы(IV), прореагировавшего с раствором гидроксида натрия, если при этом образовалась средняя соль массой 37,8 г.
7. Составьте уравнения реакций согласно схеме, назовите каждое из исходных веществ:
- а)
;
- б)
.
8. Рассчитайте минимальный объём (н. у.) сернистого газа, который нужно пропустить через раствор массой 200 г с массовой долей гидроксида натрия 2 %, чтобы получить только кислую соль.
9. Расставьте коэффициенты методом электронного баланса:
- а)
;
- б)
.
Укажите, окислителем или восстановителем является SO2.
10. Рассчитайте массовую долю серы в смеси, содержащей сульфит натрия количеством 0,5 моль и гидросульфит натрия количеством 0,2 моль.
*Самоконтроль
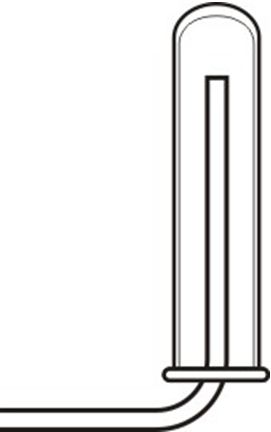
1. С наименьшими потерями сернистым газом можно наполнить сосуд:
2. При нормальных условиях оксид серы(VI):
- а) не существует;
- б) газ;
- в) жидкость;
- г) твёрдое вещество.
3. Относительно обоих оксидов серы(IV, VI) верно, что:
- а) при растворении в воде образуют кислоты;
- б) являются причиной загрязнения атмосферы и выпадения кислотных дождей;
- в) реагируя со щелочами, могут образовывать и кислые, и средние соли;
- г) могут реагировать с оксидом бария.
4. Оксид серы(VI) проявляет свойства кислотного оксида, реагируя с:
- а) О2;
- б) Na2O;
- в) Са(ОН)2;
- г) СаО.
5. Сумма коэффициентов в уравнении реакции cернистого газа с избытком гидроксида калия в полной ионной форме равна:
- а) 5;
- б) 7;
- в) 8;
- г) 9.