§ 33. Водородные соединения кислорода и серы
Сероводород
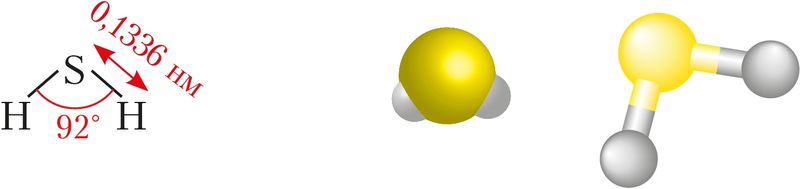
Строение молекулы. Строение молекулы сероводорода можно объяснить перекрыванием атомных 3р-орбиталей серы и 1s-орбитали атомов водорода (§ 14, рис. 32). При этом происходит отталкивание областей повышенной электронной плотности, возникших при образовании σ-связи. Вследствие этого валентный угол немного увеличивается — возрастает от 90° до 92° (рис. 78).
Физические свойства. Сероводород — бесцветный газ с запахом тухлых яиц. Он тяжелее воздуха и имеет более низкие температуры кипения (–60 °С) и плавления (–86 °С) по сравнению с водой. В одном объёме воды растворяется три объёма сероводорода. При этом образуется раствор очень слабой кислоты — сероводородной:
Из уравнений диссоциации следует, что кислоте соответствуют два ряда солей — кислые (гидросульфиды, например NaHS, Ca(HS)2) и средние (сульфиды, например Na2S, CaS).
Влияние на организм человека. Сероводород очень ядовит. При его вдыхании быстро наступает паралич дыхательных нервов, человек перестаёт ощущать запахи, что таит в себе смертельную угрозу. Попадая в кровь, сероводород разрушает гемоглобин и образует сульфид железа чёрного цвета — «кровь чернеет». Работать с сероводородом в лабораториях можно только в вытяжном шкафу.
В природе сероводород образуется в небольших количествах при гниении белков, содержится в вулканических газах, в атмосфере промышленных регионов. Сероводород тяжелее воздуха, поэтому скапливается в канализационных колодцах, ямах. Насчитывается немало случаев, когда пострадавшими становились рабочие, обслуживающие трубопроводы.
В организме сероводород образуется из аминокислоты — цистеина. Эндогенный (вырабатываемый внутри организма) сероводород является спазмолитиком — расслабляет гладкие мышцы, а также считается одним из важных факторов, защищающих организм от сердечно-сосудистых заболеваний.
Применение сероводорода и сульфидов. Сероводород находит ограниченное применение. Сероводородную воду и газообразный сероводород используют в аналитической химии для определения (осаждения) катионов металлов, сульфиды которых малорастворимы и нерастворимы.
Сульфиды многих металлов ярко окрашены: HgS, Ag2S, PbS, CuS — чёрные, Sb2S3 — оранжевый, CdS — жёлтый, MnS — розовый, ZnS — белый. Сульфиды щелочных и щёлочноземельных металлов бесцветны.
Одной из основных причин потемнения картин старых мастеров является использование ими свинцовых белил. Взаимодействуя даже со следовым количеством сероводорода в воздухе, белила за несколько веков превращаются в чёрный сульфид свинца(II) PbS. При реставрации его окисляют пероксидом водорода: PbS(чёрный) + 4H2O2 = PbSO4(белый) + 4H2O.
В технике сульфиды применяют как источники нетеплового излучения — люминофоры (CdS, ZnS), смазочные материалы (МоS2), полупроводники (CuS, CdS, PbS и другие).
В медицине используют искусственные и природные сероводородные ванны, сероводородную минеральную воду.
В химической промышленности сероводород служит сырьём для получения серы, серной кислоты, сульфидов и серосодержащих органических соединений. Например, меркаптаны как одни из самых зловонных веществ служат добавкой к природному газу для обнаружения его утечки в трубопроводах.