§ 33. Водородные соединения кислорода и серы
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 33. Водородные соединения кислорода и серы |
| Напечатано:: | Гость |
| Дата: | Monday, 20 October 2025, 06:36 |
Важнейшими водородными соединениями кислорода и серы являются вода H2O и сероводород H2S. Кроме того, существуют и другие бинарные соединения кислорода и серы, например пероксид водорода Н2О2.
Вода
Вода — второе по распространённости на Земле химическое соединение. Запасы воды на Земле оцениваются в 1,4 млрд км3. Она составляет от 50 до 99 % массы растений, животных, человека.
Строение молекулы. Молекула воды имеет угловое строение, которое определяют четыре электронные орбитали внешнего электронного слоя атома кислорода: две из них образуют ковалентные полярные связи с атомами водорода, другие две содержат неподелённые электронные пары (рис. 77). Как вам известно, угол между направлениями связей Н—О в молекуле водяного пара составляет 104,5° и молекулы представляют собой диполи (§ 14, рис. 33).
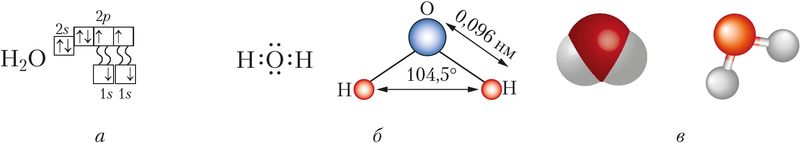
Особенности физических свойств. Вода не имеет цвета, вкуса, запаха, обладает высокой теплоёмкостью. Вода существует в природе в трёх агрегатных состояниях (жидком, твёрдом, газообразном). Её температура плавления — 0 °С, кипения — 100 °С при p = 101,325 кПа. Между молекулами воды в жидком и твёрдом состояниях существуют прочные водородные связи (25 кДж/моль) (§ 17, рис. 43).
Вода, являясь очень слабым электролитом, практически не проводит электрический ток. На ионы распадаются приблизительно две молекулы из миллиарда (при 25 °С): .
Химические свойства воды. Вода вступает в реакции со многими веществами как при комнатной температуре, так и при нагревании: металлами, основными и кислотными оксидами, органическими веществами. Рассмотрим некоторые особенности этих взаимодействий.
1. Характер взаимодействия воды с металлами зависит от активности металла. Так, щелочные и щёлочноземельные (Са, Ва, Sr, Ra) металлы реагируют при комнатной температуре с образованием водорода и щёлочи:
Большинство металлов, расположенных в ряду активности между алюминием и водородом, вступают в реакцию с парами воды с образованием водорода и оксидов металлов. Металлы, расположенные после водорода, ни при каких условиях с водой не реагируют. Более детально вы изучите реакции взаимодействия металлов с водой в главе 7.
2. Взаимодействие воды с кислотными оксидами приводит к образованию кислот:
SO3 + H2O = H2SO4.
3. Основные оксиды щелочных и щёлочноземельных металлов в реакциях с водой образуют щёлочи:
СаО + Н2О = Са(ОН)2↓.
4. С органическими веществами вода вступает в реакции гидратации (ненасыщенных соединений) и гидролиза (сложных эфиров, углеводов, белков). Например:
Гидролиз белков, ди- и полисахаридов, жиров — это первый этап усвоения (переваривания) пищи.
5. Вода вступает в реакции с галогенами. Фтор окисляет кислород в молекуле воды:
2H2O + 2F2 = 4HF + O2↑.
Реакции с хлором и бромом протекают обратимо с образованием двух кислот, в одной из которых степень окисления атома галогена повышена, а в другой понижена:
6. С ионными гидридами металлов вода выступает в качестве окислителя:
NaH + H2O = NaOH + H2↑.
7. Соли слабых кислот и соли неактивных металлов, а также соли аммония в водной среде подвергаются гидролизу (см. § 27.1.):
СН3СОО– + НОН СН3СООН + ОН–;
.
Сероводород
Строение молекулы. Строение молекулы сероводорода можно объяснить перекрыванием атомных 3р-орбиталей серы и 1s-орбитали атомов водорода (§ 14, рис. 32). При этом происходит отталкивание областей повышенной электронной плотности, возникших при образовании σ-связи. Вследствие этого валентный угол немного увеличивается — возрастает от 90° до 92° (рис. 78).
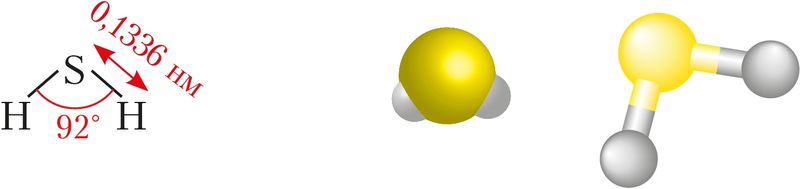
Физические свойства. Сероводород — бесцветный газ с запахом тухлых яиц. Он тяжелее воздуха и имеет более низкие температуры кипения (–60 °С) и плавления (–86 °С) по сравнению с водой. В одном объёме воды растворяется три объёма сероводорода. При этом образуется раствор очень слабой кислоты — сероводородной:
Из уравнений диссоциации следует, что кислоте соответствуют два ряда солей — кислые (гидросульфиды, например NaHS, Ca(HS)2) и средние (сульфиды, например Na2S, CaS).
Влияние на организм человека. Сероводород очень ядовит. При его вдыхании быстро наступает паралич дыхательных нервов, человек перестаёт ощущать запахи, что таит в себе смертельную угрозу. Попадая в кровь, сероводород разрушает гемоглобин и образует сульфид железа чёрного цвета — «кровь чернеет». Работать с сероводородом в лабораториях можно только в вытяжном шкафу.
В природе сероводород образуется в небольших количествах при гниении белков, содержится в вулканических газах, в атмосфере промышленных регионов. Сероводород тяжелее воздуха, поэтому скапливается в канализационных колодцах, ямах. Насчитывается немало случаев, когда пострадавшими становились рабочие, обслуживающие трубопроводы.
В организме сероводород образуется из аминокислоты — цистеина. Эндогенный (вырабатываемый внутри организма) сероводород является спазмолитиком — расслабляет гладкие мышцы, а также считается одним из важных факторов, защищающих организм от сердечно-сосудистых заболеваний.
Применение сероводорода и сульфидов. Сероводород находит ограниченное применение. Сероводородную воду и газообразный сероводород используют в аналитической химии для определения (осаждения) катионов металлов, сульфиды которых малорастворимы и нерастворимы.
Сульфиды многих металлов ярко окрашены: HgS, Ag2S, PbS, CuS — чёрные, Sb2S3 — оранжевый, CdS — жёлтый, MnS — розовый, ZnS — белый. Сульфиды щелочных и щёлочноземельных металлов бесцветны.
Одной из основных причин потемнения картин старых мастеров является использование ими свинцовых белил. Взаимодействуя даже со следовым количеством сероводорода в воздухе, белила за несколько веков превращаются в чёрный сульфид свинца(II) PbS. При реставрации его окисляют пероксидом водорода: PbS(чёрный) + 4H2O2 = PbSO4(белый) + 4H2O.
В технике сульфиды применяют как источники нетеплового излучения — люминофоры (CdS, ZnS), смазочные материалы (МоS2), полупроводники (CuS, CdS, PbS и другие).
В медицине используют искусственные и природные сероводородные ванны, сероводородную минеральную воду.
В химической промышленности сероводород служит сырьём для получения серы, серной кислоты, сульфидов и серосодержащих органических соединений. Например, меркаптаны как одни из самых зловонных веществ служат добавкой к природному газу для обнаружения его утечки в трубопроводах.
*Химические свойства сероводорода
Для сероводорода наиболее характерны восстановительные свойства за счёт атомов серы в степени окисления –2. Примером может служить взаимодействие сероводорода с кислородом и оксидом серы(IV).
1. При взаимодействии с кислородом (горение) в избытке кислорода образуется оксид серы(IV), а при его недостатке — сера:
;
.
2. При взаимодействии с оксидом серы(IV) образуется свободная сера:
.
Эти процессы лежат в основе промышленного получения серы при нефтепереработке, а также из отходящих газов металлургических и коксовых печей.
Сероводородная кислота и её соли
Слабая двухосновная сероводородная кислота проявляет все общие свойства кислот: реагирует с металлами, основными оксидами, основаниями и солями. Вступая в реакции обмена, она образует два ряда солей — сульфиды и гидросульфиды:
2NaOH + H2S = Na2S + 2H2O (cульфид натрия, средняя соль);
NaOH + H2S = NaHS + H2O (гидросульфид натрия, кислая соль).
Сульфиды и гидросульфиды щелочных и щёлочноземельных металлов (NaHS, KНS, Ba(HS)2) хорошо растворяются в воде. Сульфиды других металлов в подавляющем большинстве нерастворимы. Сульфиды свинца, меди, ртути, серебра и некоторых других металлов не растворяются даже в соляной и серной кислотах. По этой причине сульфиды можно осаждать сероводородом из растворов солей:
CuSO4 + H2S = CuS↓ + H2SO4.
Сульфид-ионы легко обнаружить, используя качественную реакцию на сероводородную кислоту и её соли. Реактивом на сероводородную кислоту и её растворимые в воде соли могут быть, например, сульфат меди(II) или нитрат свинца(II), при взаимодействии с которыми из раствора выпадает чёрный осадок сульфида меди(II) или свинца(II):
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3;
Pb2+ + S2– = PbS↓.
Сульфиды большинства металлов, причём даже нерастворимые в воде, обнаруживают по их взаимодействию с кислотой, в результате которого выделяется сероводород, имеющий специфический неприятный запах.
Молекулы воды и сероводорода имеют угловое строение.
Вода реагирует при комнатной температуре с активными металлами, кислотными и основными оксидами.
Водный раствор сероводорода — слабая кислота.
Вопросы, задания, задачи
1. Назовите химические формулы водородных соединений кислорода и серы.
2. Перечислите физические свойства:
- а) воды;
- б) сероводорода.
Каково физиологическое воздействие сероводорода на организм?
3. Опишите пространственное строение:
- а) молекулы воды;
- б) молекулы сероводорода.
Сравните валентные углы в данных молекулах.
4. Назовите вещества и укажите степени окисления атомов:
Н2S, H2O2, ZnS, FeS, Al2S3, NaHS.
5. Составьте уравнения реакций:
- а) Na + H2O →; Ba + H2O →; P2O5 + H2O →; SO2 + H2O →;
- б) H2S + FeCl2 →; H2S + NaOH →; H2S + Ba(OH)2 →; H2S + CuSO4 →.
На основании составленных уравнений реакций сделайте вывод о химических свойствах водородного соединения.
6. Составьте схему образования водородных связей:
- а) между молекулами воды;
- б) молекулами воды и метанола.
Объясните, почему не растворяются в воде бензол, гексан.
7. Используя данные рисунка 44 из § 17, объясните:
- а) изменение температуры кипения веществ в ряду H2S — H2Sе — H2Те;
- б) аномально высокое значение температуры кипения воды.
8. Рассчитайте массовую долю сероводорода в сероводородной воде, полученной при растворении газа (н. у.) объёмом 3 дм3 в воде объёмом 1 дм3 (4 °С).
9. Через раствор, содержащий гидроксид натрия массой 20 г, пропустили сероводород объёмом 11,2 дм3 (н. у.). Определите молярную концентрацию соли в конечном растворе, если известно, что объём раствора равен 2,5 дм3.
10. Cероводород объёмом 1,12 дм3 (н. у.) пропустили через раствор массой 125 г с массовой долей сульфата меди(II), равной 10 %. Рассчитайте массовую долю соли в образовавшемся растворе.
*Самоконтроль
1. К водородным соединениям элементов VIA-группы относятся:
- а) H2O;
- б) H2O2;
- в) H2S2;
- г) H2S.
2. Назовите вещество, которое при попадании в кровь разрушает гемоглобин:
- а) H2O;
- б) O2;
- в) С6H12О6 (глюкоза);
- г) H2S.
3. При комнатной температуре реагируют:
- а) вода и калий;
- б) сероводородная кислота и гидроксид натрия;
- в) магний и вода;
- г) вода и оксид бария.
4. Реагирует с водой с образованием гидроксида:
- а) цинк;
- б) кальций;
- в) железо;
- г) медь.
5. Перекрыванию электронных орбиталей в молекуле воды соответствует схема:



