§ 33. Водородные соединения кислорода и серы
Вода
Вода — второе по распространённости на Земле химическое соединение. Запасы воды на Земле оцениваются в 1,4 млрд км3. Она составляет от 50 до 99 % массы растений, животных, человека.
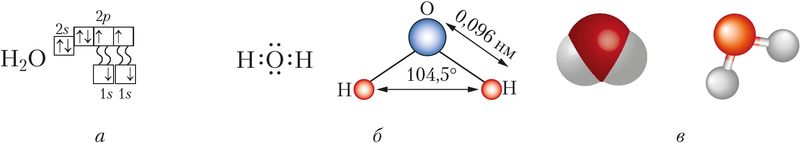
Строение молекулы. Молекула воды имеет угловое строение, которое определяют четыре электронные орбитали внешнего электронного слоя атома кислорода: две из них образуют ковалентные полярные связи с атомами водорода, другие две содержат неподелённые электронные пары (рис. 77). Как вам известно, угол между направлениями связей Н—О в молекуле водяного пара составляет 104,5° и молекулы представляют собой диполи (§ 14, рис. 33).
Особенности физических свойств. Вода не имеет цвета, вкуса, запаха, обладает высокой теплоёмкостью. Вода существует в природе в трёх агрегатных состояниях (жидком, твёрдом, газообразном). Её температура плавления — 0 °С, кипения — 100 °С при p = 101,325 кПа. Между молекулами воды в жидком и твёрдом состояниях существуют прочные водородные связи (25 кДж/моль) (§ 17, рис. 43).
Вода, являясь очень слабым электролитом, практически не проводит электрический ток. На ионы распадаются приблизительно две молекулы из миллиарда (при 25 °С): .
Химические свойства воды. Вода вступает в реакции со многими веществами как при комнатной температуре, так и при нагревании: металлами, основными и кислотными оксидами, органическими веществами. Рассмотрим некоторые особенности этих взаимодействий.
1. Характер взаимодействия воды с металлами зависит от активности металла. Так, щелочные и щёлочноземельные (Са, Ва, Sr, Ra) металлы реагируют при комнатной температуре с образованием водорода и щёлочи:
Большинство металлов, расположенных в ряду активности между алюминием и водородом, вступают в реакцию с парами воды с образованием водорода и оксидов металлов. Металлы, расположенные после водорода, ни при каких условиях с водой не реагируют. Более детально вы изучите реакции взаимодействия металлов с водой в главе 7.
2. Взаимодействие воды с кислотными оксидами приводит к образованию кислот:
SO3 + H2O = H2SO4.
3. Основные оксиды щелочных и щёлочноземельных металлов в реакциях с водой образуют щёлочи:
СаО + Н2О = Са(ОН)2↓.
4. С органическими веществами вода вступает в реакции гидратации (ненасыщенных соединений) и гидролиза (сложных эфиров, углеводов, белков). Например:
Гидролиз белков, ди- и полисахаридов, жиров — это первый этап усвоения (переваривания) пищи.
5. Вода вступает в реакции с галогенами. Фтор окисляет кислород в молекуле воды:
2H2O + 2F2 = 4HF + O2↑.
Реакции с хлором и бромом протекают обратимо с образованием двух кислот, в одной из которых степень окисления атома галогена повышена, а в другой понижена:
6. С ионными гидридами металлов вода выступает в качестве окислителя:
NaH + H2O = NaOH + H2↑.
7. Соли слабых кислот и соли неактивных металлов, а также соли аммония в водной среде подвергаются гидролизу (см. § 27.1.):
СН3СОО– + НОН СН3СООН + ОН–;
.