§ 29. Водород
Водород как простое вещество
Водород как простое вещество состоит из двухатомных молекул Н2, в которых атомы связаны ковалентной одинарной σ-связью, образующейся при перекрывании 1s-орбиталей:
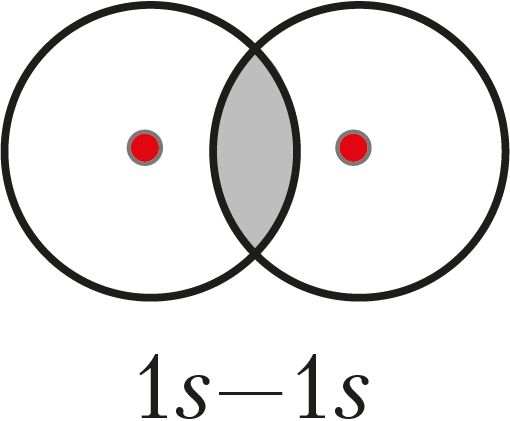
Электронная и графическая формулы молекулы имеют вид: Н:Н и Н—Н.
Физические свойства. Водород при нормальных условиях — это газ без цвета, запаха и вкуса, плотностью 0,089 г/дм3. Имеет очень низкие температуры кипения (–252,6 °С) и плавления (–259,2 °С). Растворимость водорода в воде как полярном растворителе мала, поэтому его можно собирать в сосуд методом вытеснения воды. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.).
Химические свойства. Химическая активность водорода при комнатной температуре небольшая, так как высока прочность ковалентной связи в молекуле. В химических реакциях водород может быть как восстановителем (что более характерно), так и окислителем.
1. Реакции с простыми веществами:
а) реагирует как восстановитель с неметаллами, атомы которых имеют по сравнению с водородом более высокую электроотрицательность — галогенами, азотом, серой, кислородом:
Следует отметить, что водород не взаимодействует с фосфором и кремнием;
б) реагирует как окислитель со щелочными и щёлочноземельными металлами, образуя гидриды:
Гидриды легко разлагаются водой с выделением водорода:
2. Реакции со сложными веществами:
а) взаимодействует с некоторыми оксидами металлов В-групп как восстановитель:
б) реагирует с органическими веществами, содержащими кратные связи (реакция гидрирования) — алкенами, алкинами, диенами, аренами, а также альдегидами. Например:
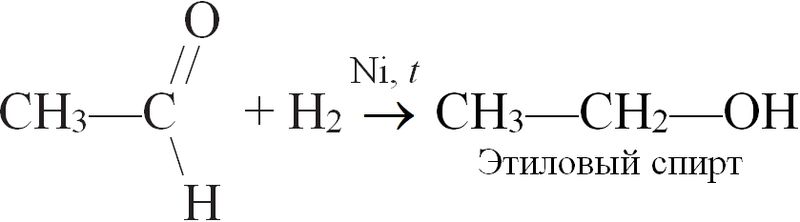
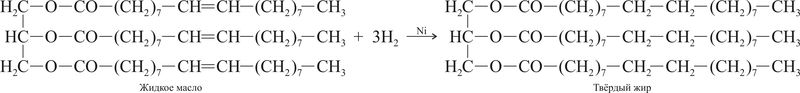
Реагирует с триглицеридами, содержащими остатки ненасыщенных карбоновых кислот:
Получение. Для получения водорода в лаборатории применяют металлы cредней активности (цинк, алюминий, железо) и кислоты (хлороводородную или серную):
Zn + 2НCl = ZnCl2 + Н2↑.
При этом часто используют аппарат Киппа — устройство, позволяющее получать газообразные вещества и регулировать их ток (рис. 63).
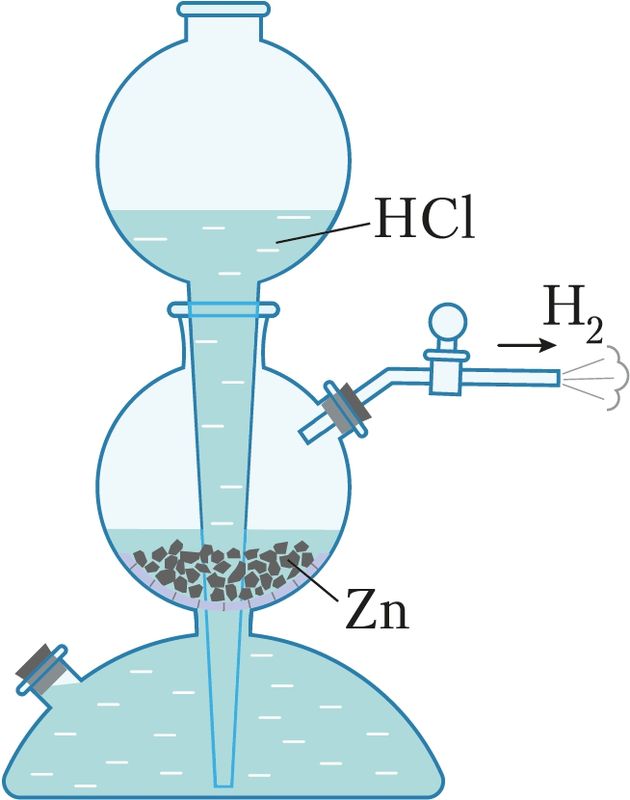
Получение водорода
в лаборатории
Важнейшими способами получения водорода в промышленности являются:
1) взаимодействие паров воды с метаном:
2) взаимодействие паров воды с раскалённым коксом:
3) электролиз воды (в присутствии электролита):
Применение. Одно из важнейших физических свойств водорода — малая плотность, поэтому его используют для наполнения зондов, исследующих верхние слои атмосферы.
В химической промышленности водород используют для получения аммиака NH3, хлороводорода НСl, метанола (СО + 2Н2 = СН3ОН), многих металлов из их оксидов, например тугоплавких молибдена и вольфрама. Уже сейчас работают заводы, на которых для восстановления оксидов железа до металла вместо углерода (кокса) используют водород. Водород находит применение в производстве маргарина из растительных масел.
Реакция горения водорода в кислороде (2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж) используется в ракетных двигателях, выводящих в космос летательные аппараты (рис. 64). Например, мощная космическая ракета «Энергия» потребляет более 2000 тонн топлива, большую часть которого составляют жидкие водород и кислород. В настоящее время начато производство автомобилей, топливом в которых служит водород (рис. 65).
Эту же реакцию применяют и для сварочных работ (рис. 66). При использовании специальных горелок достигают температуры пламени около 4000 °C, что позволяет проводить сварочные работы с самыми тугоплавкими материалами.

ракеты


кислородно-водородным пламенем
Учёные разных стран ведут поиски путей замены на водород нефти, газа и угля как топлива. При сгорании последних образуются вещества, загрязняющие и разрушающие окружающую среду (СО2, СО, SO2 и др.), в то время как продуктом сгорания водорода является экологически чистое вещество — вода.