§ 29. Водород
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 29. Водород |
| Напечатано:: | Гость |
| Дата: | Friday, 21 November 2025, 06:42 |
Водород как химический элемент

Имея самую малую массу атома, атом водорода имеет и самое простое строение: ядро, представляющее собой протон, и один электрон, который размещается на 1s-орбитали. Электронная конфигурация 1Н 1s1, электронно-графическая схема:
Электроотрицательность водорода равна 2,2. Это выше, чем у металлов, кремния, но меньше электроотрицательности кислорода и других халькогенов, галогенов. Поэтому для водорода характерны степени окисления –1, 0 и +1, например, (гидрид лития),
(силан),
(метан),
(оксид водорода, вода).
Как вы уже знаете, природный водород состоит из двух стабильных изотопов — (протий — 99,98 % от общего числа атомов),
(дейтерий D — 0,015 %) и радиоактивного
(тритий Т — следовые количества) (§ 7, рис. 12).
Водород является самым распространённым элементом во Вселенной. На Земле на долю водорода по массе, считая воду и воздух, приходится около 1 %, а при пересчёте от общего числа атомов — около 17 %. Водород преимущественно находится в связанном состоянии. Он входит в состав воды, нефти, природного газа, живых организмов. В виде простого вещества водород почти не встречается. Следовые количества его обнаружены в верхних слоях атмосферы, вулканических газах и продуктах разложения бактериями органических веществ в условиях недостатка воздуха.
Водород как простое вещество
Водород как простое вещество состоит из двухатомных молекул Н2, в которых атомы связаны ковалентной одинарной σ-связью, образующейся при перекрывании 1s-орбиталей:
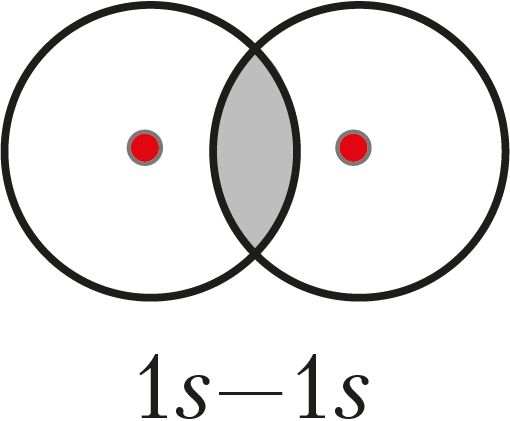
Электронная и графическая формулы молекулы имеют вид: Н:Н и Н—Н.
Физические свойства. Водород при нормальных условиях — это газ без цвета, запаха и вкуса, плотностью 0,089 г/дм3. Имеет очень низкие температуры кипения (–252,6 °С) и плавления (–259,2 °С). Растворимость водорода в воде как полярном растворителе мала, поэтому его можно собирать в сосуд методом вытеснения воды. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.).
Химические свойства. Химическая активность водорода при комнатной температуре небольшая, так как высока прочность ковалентной связи в молекуле. В химических реакциях водород может быть как восстановителем (что более характерно), так и окислителем.
1. Реакции с простыми веществами:
а) реагирует как восстановитель с неметаллами, атомы которых имеют по сравнению с водородом более высокую электроотрицательность — галогенами, азотом, серой, кислородом:
Следует отметить, что водород не взаимодействует с фосфором и кремнием;
б) реагирует как окислитель со щелочными и щёлочноземельными металлами, образуя гидриды:
Гидриды легко разлагаются водой с выделением водорода:
2. Реакции со сложными веществами:
а) взаимодействует с некоторыми оксидами металлов В-групп как восстановитель:
б) реагирует с органическими веществами, содержащими кратные связи (реакция гидрирования) — алкенами, алкинами, диенами, аренами, а также альдегидами. Например:
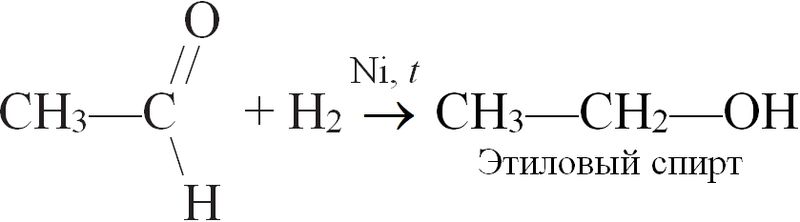
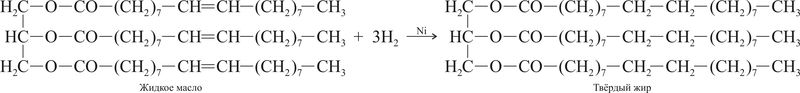
Реагирует с триглицеридами, содержащими остатки ненасыщенных карбоновых кислот:
Получение. Для получения водорода в лаборатории применяют металлы cредней активности (цинк, алюминий, железо) и кислоты (хлороводородную или серную):
Zn + 2НCl = ZnCl2 + Н2↑.
При этом часто используют аппарат Киппа — устройство, позволяющее получать газообразные вещества и регулировать их ток (рис. 63).
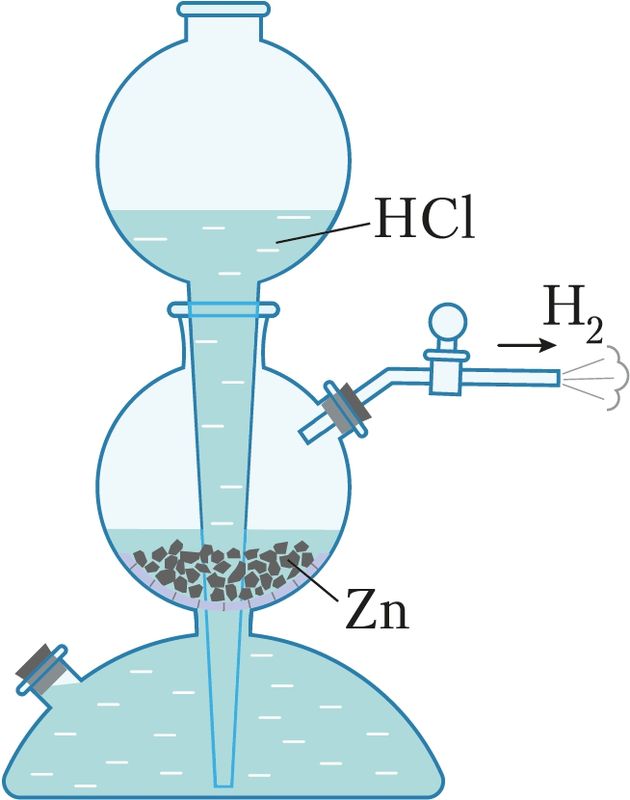
Получение водорода
в лаборатории
Важнейшими способами получения водорода в промышленности являются:
1) взаимодействие паров воды с метаном:
2) взаимодействие паров воды с раскалённым коксом:
3) электролиз воды (в присутствии электролита):
Применение. Одно из важнейших физических свойств водорода — малая плотность, поэтому его используют для наполнения зондов, исследующих верхние слои атмосферы.
В химической промышленности водород используют для получения аммиака NH3, хлороводорода НСl, метанола (СО + 2Н2 = СН3ОН), многих металлов из их оксидов, например тугоплавких молибдена и вольфрама. Уже сейчас работают заводы, на которых для восстановления оксидов железа до металла вместо углерода (кокса) используют водород. Водород находит применение в производстве маргарина из растительных масел.
Реакция горения водорода в кислороде (2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж) используется в ракетных двигателях, выводящих в космос летательные аппараты (рис. 64). Например, мощная космическая ракета «Энергия» потребляет более 2000 тонн топлива, большую часть которого составляют жидкие водород и кислород. В настоящее время начато производство автомобилей, топливом в которых служит водород (рис. 65).
Эту же реакцию применяют и для сварочных работ (рис. 66). При использовании специальных горелок достигают температуры пламени около 4000 °C, что позволяет проводить сварочные работы с самыми тугоплавкими материалами.

ракеты


кислородно-водородным пламенем
Учёные разных стран ведут поиски путей замены на водород нефти, газа и угля как топлива. При сгорании последних образуются вещества, загрязняющие и разрушающие окружающую среду (СО2, СО, SO2 и др.), в то время как продуктом сгорания водорода является экологически чистое вещество — вода.
Летучие водородные соединения
Летучие водородные соединения являются веществами молекулярного строения, которые при нормальных условиях представляют собой газы (НСl, NH3, H2S) или жидкости (Н2O, НF) (рис. 67).

Кислотно-основные свойства водных растворов летучих водородных соединений изменяются в зависимости от положения элемента в периодической системе. Известно, что СН4 не растворяется в воде, NH3 образует слабое основание NH3 · Н2O, раствор НF — слабая, а раствор HCl — сильная кислота:
Значит, кислотные свойства водородных соединений неметаллов в периоде и в группе усиливаются.
Для атома водорода характерны степени окисления –1, 0, +1. Простое вещество водород может быть как окислителем, так и восстановителем.
Водные растворы летучих водородных соединений могут проявлять свойства кислот, оснований.
Вопросы, задания, задачи
1. Назовите:
- а) изотопы водорода;
- б) возможные степени окисления атома водорода;
- в) группы веществ, с которыми может реагировать водород;
- г) реагенты для получения водорода в лаборатории.
2. Из предложенного перечня уравнений реакций выпишите те, которые характеризуют:
- а) свойства водорода;
- б) способы получения водорода:
3. Заполните таблицу «Применение водорода».
| Свойства водорода | Области применения | Уравнение реакции |
| Реакция с кислородом Взаимодействие с азотом Взаимодействие с хлором Взаимодействие с оксидами тугоплавких металлов Гидрирование бензола |
4. Составьте уравнения реакций образования водорода (металлы олово Sn и никель Ni окисляются до степени окисления +2):
- а) Мg + Н2SO4 →; Sn + HCl →; НCl + Zn →;
- б) Аl + Н2SO4 →; Ni + HCl →.
5. Определите максимальный объём водорода (н. у.), который может быть получен в аппарате Киппа при загрузке цинка массой 0,39 кг.
6. Сравните:
- а) состав ядер протия, дейтерия, трития;
- б) кислотно-основные свойства водных растворов сероводорода и хлороводорода.
7. Составьте уравнения реакций согласно схеме:
- а)
- б)
.
8. Определите количество теплоты, выделившейся при сгорании водорода объёмом 1 м3 (н. у.), если термохимическое уравнение реакции имеет вид: 2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
9. К гидриду неизвестного двухвалентного металла массой 1,05 г добавили воду в избытке. При этом выделился водород объёмом 1,12 дм3 (н. у.). Определите металл.
10. В системе установилось равновесие: . Известно, что к этому моменту прореагировало 35 % водорода и образовалось 7 моль аммиака. Определите исходную массу водорода.
*Подготовьте сообщение «Водород — топливо будущего».
*Самоконтроль
1. Для получения водорода в лаборатории используют металлы:
- а) Сu;
- б) Ca;
- в) Fe;
- г) Zn.
2. Для собирания водорода без значительных потерь можно использовать сосуды:




3. Водород является окислителем в реакциях с:
- а) Вa и Na;
- б) Ca и K;
- в) Fe3O4 и WO3;
- г) Li и CН2=CН2.
4. Неблагоприятные последствия для окружающей среды создаёт попадание в атмосферу:
- а) СО2;
- б) Н2О;
- в) SO2;
- г) Н2S.
5. Сумма коэффициентов в уравнении реакции полного восстановления водородом оксида железа(II,III):
- а) 4;
- б) 8;
- в) 10;
- г) 12.