§ 28. Общая характеристика неметаллов
Строение электронных оболочек атомов неметаллов
Внешний электронный слой атома во многом определяет свойства элемента. Число электронов внешнего уровня атомов неметаллов соответствует номеру А-группы, в которой расположен элемент. У большинства из них он близок к завершению или завершён, содержит четыре и более электронов. Меньшее число электронов содержат атомы лишь трёх элементов: водород имеет один электрон (до завершения не хватает одного электрона), гелий — два электрона (внешний уровень завершён), бор — три электрона. Неметаллы являются представителями p-элементов, за исключением водорода и гелия, принадлежащих к s-элементам.
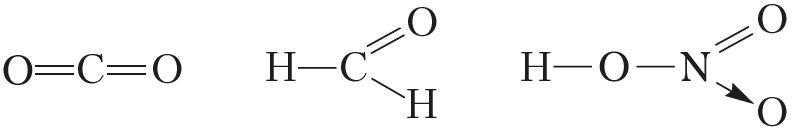
Атомы неметаллов, в отличие от атомов металлов, способны проявлять как положительные степени окисления, так и отрицательные. Исключением являются фтор и благородные газы. В соединениях с другими элементами для фтора характерна лишь отрицательная степень окисления, равная –1 (например, ,
,
). Наиболее лёгкие благородные газы — гелий, неон и аргон — устойчивых соединений не образуют, а для ксенона, криптона и радона получены соединения лишь с положительными степенями окисления (например,
,
).
В целом значения степеней окисления неметаллов лежат в интервале от –4 до +8, а валентности — от I до VIII. Следует вспомнить, что валентность атомов элементов второго периода не бывает больше четырёх: