§ 28. Общая характеристика неметаллов
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 28. Общая характеристика неметаллов |
| Напечатано:: | Гость |
| Дата: | Sunday, 31 August 2025, 03:47 |
Положение в периодической системе
Химические элементы принято делить на металлы и неметаллы по их химическим свойствам. В периодической системе неметаллы расположены в А-группах: IА, IIIА–VIIIА. От металлов их отделяет ступенчатая линия водород — бор — оганесон. Неметаллы находятся выше этой линии, то есть занимают правый верхний угол таблицы, образуя своеобразный треугольник (рис. 61).
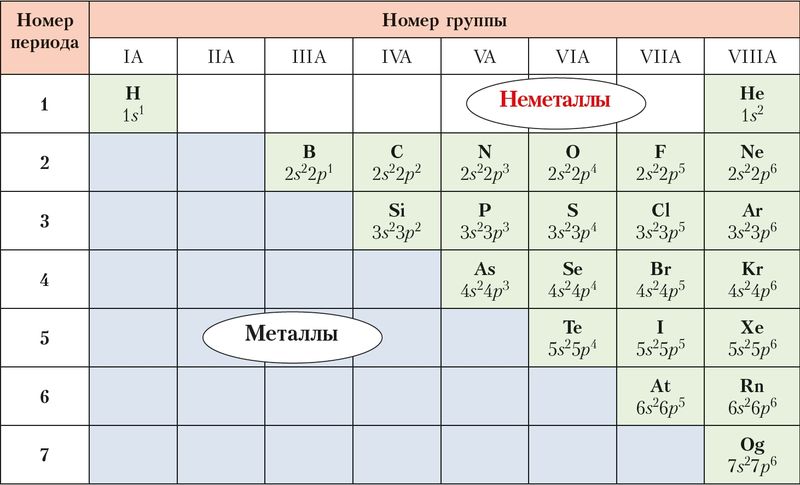
Элементы, расположенные в одной группе, сходны по строению атома, а значит, во многом и по свойствам. Поэтому для некоторых групп неметаллов применяют общие названия. Так, неметаллы VIIIA-группы называют благородными газами. Для элементов VIIA-группы используют название галогены — рождающие соли. Неметаллы VIA-группы имеют общее название халькогены — рождающие руды.
По электрофизическим свойствам, в отличие от химических, простые вещества, состоящие из атомов тех или иных элементов, подразделяют на три группы: металлы, полупроводники и диэлектрики. Различить эти вещества можно не только по величине электропроводности, но и по характеру её зависимости от температуры. С ростом температуры электропроводность металлов падает, а полупроводников и диэлектриков растёт. Типичные полупроводники — кремний и германий.
Строение электронных оболочек атомов неметаллов
Внешний электронный слой атома во многом определяет свойства элемента. Число электронов внешнего уровня атомов неметаллов соответствует номеру А-группы, в которой расположен элемент. У большинства из них он близок к завершению или завершён, содержит четыре и более электронов. Меньшее число электронов содержат атомы лишь трёх элементов: водород имеет один электрон (до завершения не хватает одного электрона), гелий — два электрона (внешний уровень завершён), бор — три электрона. Неметаллы являются представителями p-элементов, за исключением водорода и гелия, принадлежащих к s-элементам.
Атомы неметаллов, в отличие от атомов металлов, способны проявлять как положительные степени окисления, так и отрицательные. Исключением являются фтор и благородные газы. В соединениях с другими элементами для фтора характерна лишь отрицательная степень окисления, равная –1 (например, «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mover»«mi»KF«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«/math», «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mover»«msub»«mi»§#1054;F«/mi»«mn»2«/mn»«/msub»«mpadded voffset=¨+2px¨»«mo»-«/mo»«mn»1«/mn»«/mpadded»«/mover»«/math», «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mover»«mi mathvariant=¨normal¨»C«/mi»«mpadded lspace=¨-3px¨»«mo»+«/mo»«mn»4«/mn»«/mpadded»«/mover»«mpadded lspace=¨-3px¨»«msub»«mover»«mi mathvariant=¨normal¨»F«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»4«/mn»«/msub»«/mpadded»«/math»). Наиболее лёгкие благородные газы — гелий, неон и аргон — устойчивых соединений не образуют, а для ксенона, криптона и радона получены соединения лишь с положительными степенями окисления (например, «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mover»«mi»Rn«/mi»«mrow»«mo»+«/mo»«mn»2«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»F«/mi»«mn»2«/mn»«/msub»«/math», «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mover»«mi»Xe«/mi»«mrow»«mo»+«/mo»«mn»8«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»4«/mn»«/msub»«/math»).
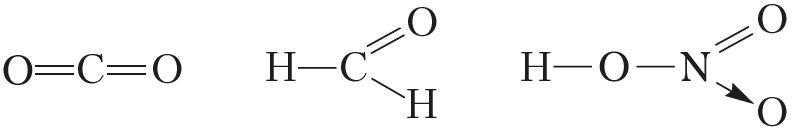
В целом значения степеней окисления неметаллов лежат в интервале от –4 до +8, а валентности — от I до VIII. Следует вспомнить, что валентность атомов элементов второго периода не бывает больше четырёх:
Простые вещества
В исторически сложившейся классификации элементов принадлежность к неметаллам определяли по физическим свойствам простых веществ: твёрдое, газообразное или жидкое состояние при нормальных условиях. В твёрдом состоянии у неметаллов, как правило, отсутствует металлический блеск. Их электро- и теплопроводность обычно невелики, вещества являются хрупкими.
Неметаллы образуют два типа кристаллов — молекулярные и атомные (рис. 62).
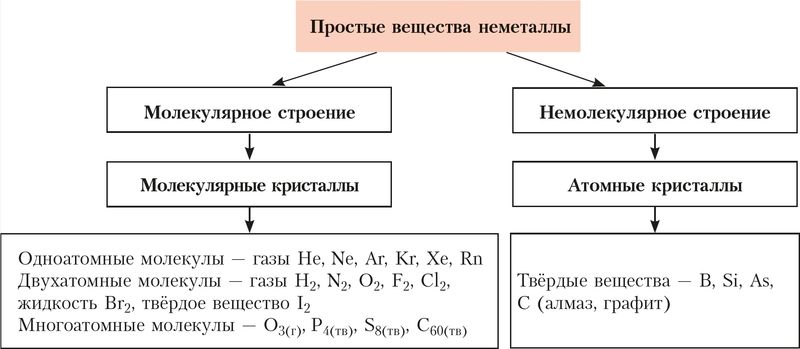
Вещества молекулярного строения отличаются низкими температурами плавления (гелий –272 °С, кислород –223 °С) и кипения (гелий –269 °С, кислород –183 °С). Неметаллы немолекулярного строения, наоборот, имеют чрезвычайно высокие температуры кипения и плавления (графит: Tпл. = 3850 °С, Tкип.= 4200 °С).
Для неметаллов характерно явление аллотропии. Примерами могут служить красный и белый фосфор, алмаз и графит, кислород и озон.
Неметаллы могут вступать в реакции с веществами всех классов (металлами, другими неметаллами, оксидами, щелочами, кислотами, солями) и проявлять как окислительные, так и восстановительные свойства (табл. 20).
Таблица 20. Общие свойства неметаллов как простых веществ
| Неметаллы как окислители вступают в реакции | Неметаллы как восстановители вступают в реакции |
| С металлами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«mi»Mg«/mi»«mn»0«/mn»«/mover»«mover»«mrow»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«msub»«mover»«mi»Mg«/mi»«mrow»«mo»+«/mo»«mn»2«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mrow»«mo»-«/mo»«mn»4«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mrow»«/mstyle»«/math» |
С некоторыми оксидами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mn»3«/mn»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mover»«mi»Fe«/mi»«mrow»«mo»+«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mrow»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mrow»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«mn»3«/mn»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mrow»«mo»+«/mo»«mn»4«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»4«/mn»«mover»«mi mathvariant=¨normal¨»F«/mi»«mn»0«/mn»«/mover»«mi mathvariant=¨normal¨»e«/mi»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С другими неметаллами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mover»«mrow»«mn»2«/mn»«mi mathvariant=¨normal¨»P«/mi»«mo»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»3«/mn»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mover»«mo»=«/mo»«mi»t«/mi»«/mover»«mrow»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»P«/mi»«mrow»«mo»+«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«/mrow»«mover»«msub»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mn»3«/mn»«/msub»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mrow»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«/mrow»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mrow»«/mstyle»«/math» |
С другими неметаллами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»=«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mrow»«mo»+«/mo»«mn»4«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С кислотами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mover»«msub»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mn»2«/mn»«/msub»«mn»0«/mn»«/mover»«mo»+«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mover»«mi mathvariant=¨normal¨»S«/mi»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/mover»«mo»§#160;«/mo»«mo»(«/mo»«mi»§#1088;§#1072;§#1089;§#1090;§#1074;§#1086;§#1088;«/mi»«mo»)«/mo»«mo»=«/mo»«mover»«mi mathvariant=¨normal¨»S«/mi»«mn»0«/mn»«/mover»«mpadded voffset=¨+1px¨»«mo»§#8595;«/mo»«/mpadded»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»§#160;«/mo»«mo»(«/mo»«mi»§#1088;§#1072;§#1089;§#1090;§#1074;§#1086;§#1088;«/mi»«mo»)«/mo»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
С органическими веществами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mi»CH«/mi»«mo»§#8801;«/mo»«mi»CH«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mrow»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mn mathvariant=¨bold¨»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mo stretchy=¨false¨»§#8594;«/mo»«mpadded voffset=¨-3px¨»«mi»t«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»Ni«/mi»«/mpadded»«/mover»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»C«/mi»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»3«/mn»«/msub»«mo»-«/mo»«mi mathvariant=¨normal¨»C«/mi»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»3«/mn»«/msub»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С солями: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«mrow»«mi»KI«/mi»«mo»§#160;«/mo»«/mrow»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»=«/mo»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»I«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mpadded voffset=¨+1px¨»«mo»§#8595;«/mo»«/mpadded»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»K«/mi»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«mo»§#160;«/mo»«/mrow»«/mstyle»«/math» |
Окислительные способности атомов неметаллов можно сравнивать по положению в периодической системе: с ростом атомного номера они увеличиваются в периодах и уменьшаются, как правило, в группах. Эти же свойства можно также оценивать, сопоставляя электроотрицательность неметаллов, которая возрастает в ряду:
| Si | B | As | As | H | C | I | S | Br | Cl | N | O | F |
| 1,9 | 2,0 | 2,1 | 2,2 | 2,2 | 2,5 | 2,5 | 2,6 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Окислительная способность неметаллов с увеличением электроотрицательности усиливается.
Распространённость неметаллов в природе
В природе неметаллы существуют не только в виде соединений (органические вещества, оксиды Н2О, SiO2, СО2, соли бескислородных кислот NaCl, As2S3, соли кислородсодержащих кислот СаСО3, Са3(РО4)2), но и в свободном виде, например азот, кислород, благородные газы, углерод (в форме графита и алмаза), сера. Существование неметаллов в виде простых веществ в природе связано с низкой активностью перечисленных неметаллов при нормальных условиях: атомы благородных газов имеют завершённый внешний электронный уровень, кислород и азот — достаточно прочные ковалентные связи в двухатомных молекулах, углерод образует прочные атомные кристаллы. На Земле самыми распространёнными неметаллами являются кислород и кремний (по массе около 49 % и 26 % соответственно), во Вселенной — водород.
Применение неметаллов
Области применения простых веществ неметаллов обширны. Примерами могут служить: производство полупроводниковых материалов (кремний, селен), металлургические процессы получения металлов (углерод, водород) и сплавов (бор, кремний), интенсификация процессов горения (кислород), создание инертной атмосферы (азот, благородные газы), органический синтез (хлор, бром), воздухоплавание (гелий, водород), светотехника (благородные газы).
Неметаллы являются представителями s- и р-элементов.
Степени окисления неметаллов изменяются от –4 до +8.
В химических реакциях неметаллы проявляют как окислительные, так и восстановительные свойства.
Вопросы, задания, задачи
1. Опишите положение неметаллов в периодической системе. Укажите для элементов-неметаллов третьего периода возможные значения степени окисления и валентности.
2. Запишите символы элементов и общую формулу электронной конфигурации:
- а) благородных газов;
- б) галогенов;
- в) халькогенов.
3. Определите степени окисления атомов в соединениях:
- а) НСl, HClO, HClO3, HClO4;
- б) H2S, SO2, H2SO3, H2SO4.
4. Укажите утверждения, характеризующие кислород как химический элемент:
- а) объёмная доля кислорода в воздухе составляет 21 %;
- б) атом кислорода содержит шесть электронов на внешнем энергетическом уровне;
- в) массовая доля кислорода в земной коре равна 49 %;
- г) при выплавке чугуна используют воздух, обогащённый кислородом;
- д) электроотрицательность кислорода меньше, чем фтора;
- е) кислород в соединениях проявляет степени окисления от –2 до +2.
5. Составьте уравнения реакций с участием неметаллов, учитывая, что атомы неметаллов в заданных реакциях проявляют низшую степень окисления:
- Al + Cl2 →;
- Li + N2 →;
- Ca + P →;
- Zn + Br2 →;
- K + H2 →;
- Al + S →.
6. Определите массу углерода, необходимого для восстановления железа из оксида железа(III) массой 1 т. Углерод окисляется до высшей степени окисления.
7. Азот имеет очень низкие температуры плавления и кипения –210 °C и –196 °C, а бор высокие — ≈2075 °C и ≈3800 °C соответственно. Дайте объяснение такому различию.
8. Докажите, что фосфор выполняет функцию восстановителя в первой реакции и окислителя — во второй:
- 1) Р + О2 → Р2О5;
- 2) Р + Са → Са3Р2.
9. Расставьте коэффициенты методом электронного баланса и укажите, окислителем или восстановителем являются простые вещества:
- а) Р + H2SO4 → H3PO4 + SO2 + H2O;
- б) S + HNO3 → H2SO4 + NO.
10. Образец газообразного простого вещества неметалла объёмом 1 дм3 (н. у.) имеет массу 3,17 г. Определите химическую формулу вещества.
*Самоконтроль
1. Конфигурацию внешнего электронного уровня ns2np5 имеют:
- а) азот;
- б) хлор;
- в) йод;
- г) фосфор.
2. Кремний как химический элемент характеризуют утверждения:
- а) кремний используют в производстве полупроводниковых приборов;
- б) кремний занимает 2-е место по распространённости в земной коре;
- в) кремний не взаимодействует с водородом непосредственно;
- г) высшая степень окисления кремния +4.
3. Положительную степень окисления проявляют элементы VA-группы в соединениях:
- а) HNO3;
- б) NH3;
- в) Li3N;
- г) H3PO4.
4. Сера является окислителем, реагируя с:
- а) Ca;
- б) Al;
- в) F2;
- г) Fe.
5. Сумма коэффициентов в реакции синтеза фосфида кальция из простых веществ равна:
- а) 3;
- б) 4;
- в) 5;
- г) 6.