§ 21. Факторы, влияющие на скорость химических реакций
Катализаторы
Проведение химических реакций в присутствии катализаторов является одним из основных способов увеличения скорости превращений веществ.
Катализ — это процесс ускорения химической реакции под действием катализатора.
Напомним, что катализаторы ускоряют химические реакции, но не входят в состав конечных продуктов. Количество катализатора, в отличие от других реагентов, практически не изменяется после реакции. Химические реакции в присутствии катализатора протекают быстрее, поскольку он обеспечивает альтернативный путь превращения.
Рассмотрим действие катализатора на примере реакции:
А2 + Б2 = 2АБ.
Без катализатора эта реакция протекает медленно. Катализатор К быстро реагирует с одним из исходных веществ, например А2, и образует реакционноспособное промежуточное соединение А2K:
А2 + K = А2K (быстрая реакция).
Промежуточное соединение A2K активно взаимодействует с другим реагентом — Б2, превращаясь в продукт реакции АБ. Катализатор K высвобождается без изменения:
А2K + Б2 = 2АБ + K (быстрая реакция).
Взаимодействие реагентов A2 и Б2 по многостадийному каталитическому пути в целом протекает гораздо быстрее, чем без катализатора.
Катализатор многократно вступает в химическое взаимодействие с участниками превращения, но свой химический состав восстанавливает. Катализатор не включается в продукты реакции.
Например, реакция этерификации между карбоновой кислотой и спиртом протекает значительно быстрее в присутствии сильной минеральной кислоты:
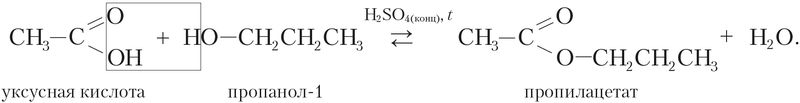
Для окисления оксида серы(IV) SO2 в оксид серы(VI) SO3 кислородом воздуха используют катализатор V2O5:
Скорость этой реакции в присутствии катализатора увеличивается примерно в 10 000 раз.