§ 21. Факторы, влияющие на скорость химических реакций
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 21. Факторы, влияющие на скорость химических реакций |
| Напечатано:: | Гость |
| Дата: | Saturday, 30 August 2025, 14:59 |
Знание скоростей химических реакций и закономерностей их протекания имеет большое научное и практическое значение. Например, в химической промышленности от скорости реакций зависят конструкция, размеры и производительность аппаратуры и даже безопасность производства.
Как было отмечено в предыдущем параграфе, скорость химической реакции определяется природой реагирующих веществ. Но скорость можно увеличить или уменьшить, изменяя условия протекания реакции.
К факторам, существенно влияющим на скорость химических реакций, относятся концентрация реагентов, температура, наличие и природа катализатора, площадь поверхности соприкосновения реагентов.
Концентрация реагирующих веществ

Скорость реакции пропорциональна числу столкновений, которые претерпевают частицы реагирующих веществ. Чем выше концентрации исходных веществ в реакционной смеси (растворе), тем чаще их частицы сталкиваются между собой, что и приводит к увеличению скорости реакции.
Температура
Скорость большинства химических реакций сильно зависит от температуры. Эту зависимость в 1884 году установил голландский химик Я. Х. Вант-Гофф — первый лауреат Нобелевской премии по химии. Он сформулировал правило, названное впоследствии его именем.
При повышении температуры на каждые 10 °С скорость большинства химических реакций увеличивается в 2–4 раза.
Математическое выражение зависимости скорости реакции от температуры имеет вид: υ2 = υ1 ∙ γΔt/10, где:
- υ2 — скорость реакции при более высокой температуре t2;
- υ1 — скорость реакции при более низкой температуре t1;
- Δt — разность температур t2 и t1;
- γ — коэффициент Вант-Гоффа, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 °С.
Так, если γ = 3, а при 20 °С реакция длится около 10 часов, то при 100 °С она пройдёт примерно за 6 секунд. Для большинства практически значимых реакций γ имеет значения от 2 до 4.
Изучая, как изменяются свойства полимеров, лекарств, масел, смазок и многих других материалов в процессе хранения, их выдерживают некоторое время при повышенных температурах. Это значительно ускоряет химические реакции распада, гидролиза, окисления веществ и другие естественные процессы, протекание которых в итоге приводит к непригодности материалов и изделий из них. Такой способ тестирования называют ускоренным старением и используют для предварительной оценки полезного срока службы изделий или срока их годности (хранения).
Выдерживание бумаги при 100 °С в течение 24 часов соответствует сроку её хранения в течение 6–8 лет при комнатной температуре. Этот приём необходим для определения продолжительности использования книг и документов.
Уменьшение температуры хранения пищевых продуктов замедляет химические процессы их порчи: окисления, разложения и др. Так, срок годности сливочного масла при температурах хранения +3, –6 и –16 °С составляет соответственно 35, 60 и 120 суток.
Катализаторы
Проведение химических реакций в присутствии катализаторов является одним из основных способов увеличения скорости превращений веществ.
Катализ — это процесс ускорения химической реакции под действием катализатора.
Напомним, что катализаторы ускоряют химические реакции, но не входят в состав конечных продуктов. Количество катализатора, в отличие от других реагентов, практически не изменяется после реакции. Химические реакции в присутствии катализатора протекают быстрее, поскольку он обеспечивает альтернативный путь превращения.
Рассмотрим действие катализатора на примере реакции:
А2 + Б2 = 2АБ.
Без катализатора эта реакция протекает медленно. Катализатор К быстро реагирует с одним из исходных веществ, например А2, и образует реакционноспособное промежуточное соединение А2K:
А2 + K = А2K (быстрая реакция).
Промежуточное соединение A2K активно взаимодействует с другим реагентом — Б2, превращаясь в продукт реакции АБ. Катализатор K высвобождается без изменения:
А2K + Б2 = 2АБ + K (быстрая реакция).
Взаимодействие реагентов A2 и Б2 по многостадийному каталитическому пути в целом протекает гораздо быстрее, чем без катализатора.
Катализатор многократно вступает в химическое взаимодействие с участниками превращения, но свой химический состав восстанавливает. Катализатор не включается в продукты реакции.
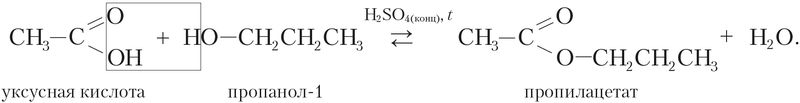
Например, реакция этерификации между карбоновой кислотой и спиртом протекает значительно быстрее в присутствии сильной минеральной кислоты:
Для окисления оксида серы(IV) SO2 в оксид серы(VI) SO3 кислородом воздуха используют катализатор V2O5:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»2«/mn»«msub»«mi»SO«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mover»«mo stretchy=¨false¨»§#8644;«/mo»«mrow»«mn»400«/mn»«mo»§#8211;«/mo»«mn»600«/mn»«mo»§#160;«/mo»«mo»§#176;«/mo»«mi mathvariant=¨normal¨»C«/mi»«mo»,«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»V«/mi»«mn»2«/mn»«/msub»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»5«/mn»«/msub»«/mrow»«/mover»«mn»2«/mn»«msub»«mi»SO«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«mo».«/mo»«/math»
Скорость этой реакции в присутствии катализатора увеличивается примерно в 10 000 раз.
Площадь поверхности соприкосновения реагирующих веществ
На скорость гетерогенных реакций сильное влияние оказывает величина площади поверхности соприкосновения реагентов. Проведём два эксперимента и убедимся в этом. Для этого в две пробирки нальём разбавленную соляную кислоту равных объёмов. В первую пробирку опустим кусочек мрамора (CaCO3), а во вторую — мраморную крошку (СaCO3) той же массы. Видно, что более интенсивное выделение газа происходит в пробирке с крошкой, и реакция с ней протекает быстрее, чем с кусочком мрамора.
Из повседневного опыта нам известно, что деревянные стружки и щепки сгорают быстрее, чем полено из того же дерева и той же массы. Это объясняется тем, что у стружек общая площадь горящей поверхности намного больше, чем у полена.
Таким образом, бо́льшая площадь поверхности соприкосновения реагентов обеспечивает бо́льшую вероятность контакта взаимодействующих частиц и увеличение скорости гетерогенных реакций. Предельным случаем «дробления» реагентов является их растворение и использование в виде растворов.
На скорость химических реакций влияют концентрация реагентов, температура, наличие катализатора и площадь поверхности соприкосновения реагентов.
Катализаторы, обеспечивая альтернативный путь превращения, ускоряют химические реакции, но не входят в состав конечных продуктов превращений.
Вопросы, задания, задачи
1. Укажите расположение магния, цинка, железа и меди в ряду активности металлов. Как это отражается на скорости их реакции с растворами кислот?
2. Почему для протекания химической реакции, как правило, недостаточно простого столкновения частиц реагентов? Какие процессы предшествуют образованию новых связей в продуктах реакции?
3. Что такое энергия активации реакции? Почему молекулы реагентов, имеющие запас энергии меньше, чем Еа, не вступают в химическую реакцию?
4. Предложите пути увеличения скорости реакции:
2Al(OH)3 = Al2O3 + 3H2O – Q.
5. Почему скорость большинства реакций возрастает при повышении температуры?
6. Почему многие лекарства хранят в холодильнике?
7. Какие вещества называются катализаторами? Приведите примеры известных вам реакций, протекающих в присутствии катализаторов.
8. Перечислите все факторы, увеличивающие скорость реакции синтеза аммиака:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mn»3«/mn»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mrow»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»N«/mi»«mn»2«/mn»«/msub»«/mrow»«mover»«mo stretchy=¨false¨»§#8644;«/mo»«mrow»«mn»400«/mn»«mo»-«/mo»«mn»500«/mn»«mo»§#160;«/mo»«mo»§#176;«/mo»«mi mathvariant=¨normal¨»C«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»Fe«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»p«/mi»«/mrow»«/mover»«mn»2«/mn»«msub»«mi»NH«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mi»Q«/mi»«mo».«/mo»«/math»
9. В закрытом сосуде постоянного объёма протекает химическая реакция: А(г) + Б(г) = В(г). До начала реакции молярная концентрация A составляла 5 моль/дм3. Скорость реакции по веществу А равна 0,06 моль/(дм3 ∙ с). Рассчитайте концентрацию вещества A через 20 с после начала реакции.
10. В химический реактор объёмом 50 дм3 ввели газообразное вещество А количеством 20 моль и газообразное вещество Б количеством 60 моль, между которыми произошла реакция А(г) + 2Б(г) = В(г). Через 3 минуты концентрация вещества А уменьшилась наполовину. Определите скорость расходования вещества Б.
*Самоконтроль
1. Скорость химических реакций зависит от:
- а) поверхности соприкосновения веществ;
- б) температуры;
- в) количества вещества;
- г) молярной концентрации вещества.
2. Взаимодействие гранул цинка с соляной кислотой будет ускоряться при:
- а) увеличении концентрации кислоты;
- б) измельчении цинковых гранул;
- в) охлаждении реакционной смеси;
- г) разбавлении кислоты.
3. Без катализатора протекают реакции:
- а) NaOH + HCl = NaCl + H2O;
- б) BaCl2 + H2SO4 = BaSO4↓+ HCl;
- в) C2H4 + H2 = C2H6;
- г) AgNO3 + NaCl = AgCl↓ + NaNO3.
4. В таблице приведены значения энергии активации для реакции разложения пероксида водорода 2H2O2 = 2H2O + O2↑ без и в присутствии катализатора:
| Наличие катализатора | Энергия активации, кДж/моль |
|---|---|
| Без катализатора | 73 |
| Платина | 48 |
| Ионы железа | 42 |
| Фермент каталаза | 7 |
Скорость разложения пероксида водорода будет наибольшей:
- а) на платиновом катализаторе;
- б) приведённые данные не позволяют сделать такой вывод;
- в) при ферментативном разложении в присутствии каталазы;
- г) в отсутствие катализаторов.
5. При увеличении температуры на каждые 10 °С скорость некоторой реакции возрастает вдвое. Температура реакционной смеси изменилась от 20 °С до 60 °С. Скорость реакции при этом возросла в:
- а) 8 раз;
- б) 16 раз;
- в) 64 раза;
- г) 128 раз.