§ 20. Скорость химических реакций
*Самоконтроль
1. Скорость химической реакции в СИ измеряется:
- а) моль/(дм3 · с);
- б) г/(дм3 · с);
- в) г/с;
- г) моль/с.
2. По графику определите, какая из реакций протекает в начальный период времени с большей скоростью:
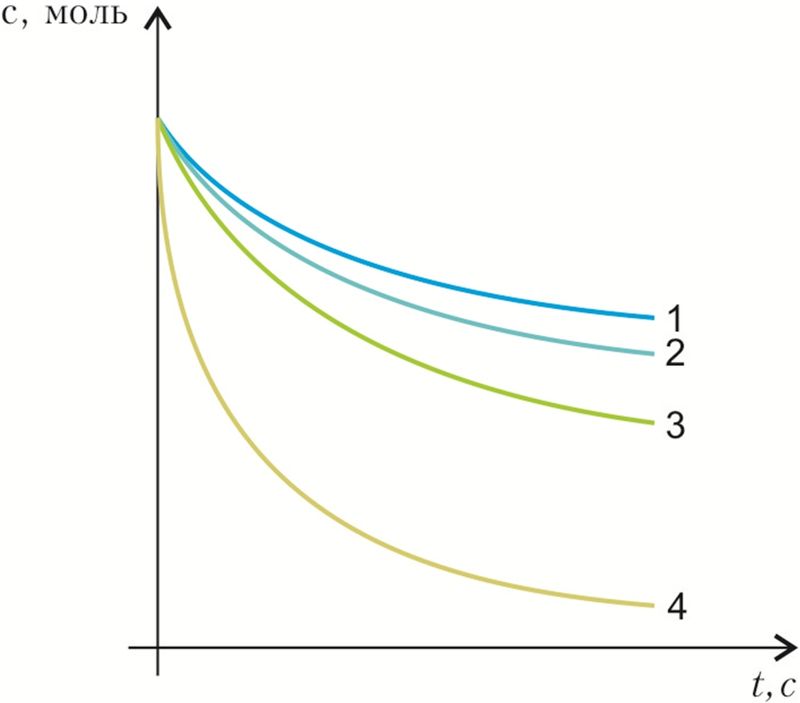
- а) 1;
- б) 2;
- в) 3;
- г) 4.
3. На рисунке показан график изменения концентрации продукта необратимой химической реакции от времени реакции. Штриховыми линиями выделены одинаковые промежутки времени: Δt1 = Δt2.
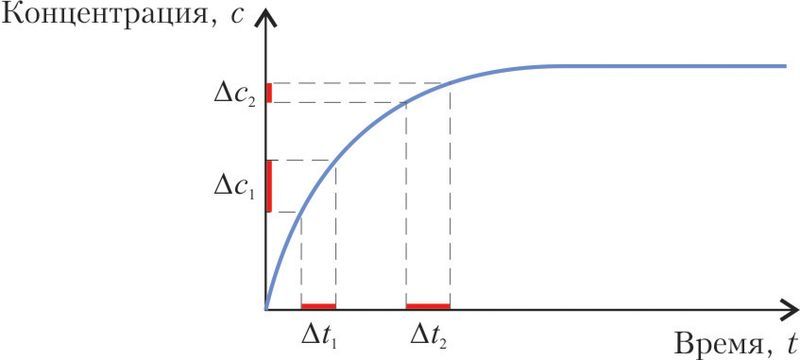
При этом справедливыми являются утверждения:
- а) скорость образования продукта в промежутке времени Δt1 выше, чем в промежутке Δt2;
- б) изменение концентрации продукта в промежутке времени Δt2 выше, чем в промежутке Δt1;
- в) концентрация продукта через определённое время перестаёт изменяться;
- г) горизонтальный участок графика свидетельствует о завершении реакции за счёт полного превращения исходных веществ в продукты.
4. Более низкой энергии активации соответствует:
- а) меньшая скорость химической реакции;
- б) более высокая скорость реакции;
- в) меньшее количество выделяемой теплоты;
- г) большее количество выделяемой теплоты.
5. В одностадийной реакции А + Б = В концентрация вещества А изменилась от 2,2 моль/дм3 до 1,6 моль/дм3 за время, равное 15 с. Среднее значение скорости расходования вещества Б равно (моль/(дм3 · с):
- а) 9;
- б) 0,6;
- в) 0,4;
- г) 0,04.