§ 14. Свойства химических связей
Вопросы, задания, задачи
1. Опишите, как образуется:
- а) тройная связь в молекуле азота;
- б) двойная связь в молекуле кислорода.
2. Заполните таблицу, поставив в ячейки под каждой химической связью подходящее значение энергии (167; 945; 418 кДж/моль) и длины связи (0,145; 0,110; 0,125 нм). Объясните свой выбор.
| Связь | |||
| Энергия, кДж/моль | |||
| Длина, нм |
3. Укажите число одинарных и кратных связей в каждой молекуле:
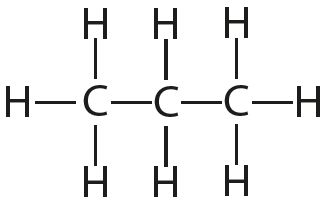
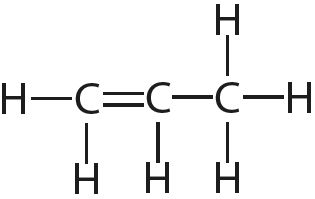
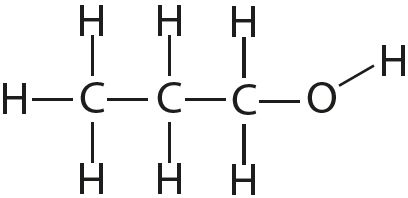
4. Отметьте полярные и неполярные ковалентные связи:
5. Объясните, почему и как меняется длина связи между атомами в ряду:
- а) углерода:
,
,
;
- б) азота:
,
.
6. Сопоставьте длину и энергию связи между атомами углерода и кислорода в ряду: метанол , метаналь
, угарный газ
![]() .
.
7. Объясните уменьшение термической устойчивости соединений в ряду: Н2О, Н2S, Н2Se.
8. Объясните, почему молекулы водорода и фтора вступают во взаимодействие мгновенно, а для взаимодействия молекул водорода и азота нужны высокие температура и давление.
9. Нарисуйте схему перекрывания атомных 1s- и 3p-орбиталей в молекуле H2X, если относительная плотность этого газообразного соединения по водороду равна 17.
10. Энергия связи в молекуле O2 равна 494 кДж/моль. Какую энергию нужно затратить, чтобы разорвать все связи в образце кислорода объёмом 1 дм3 (н. у.)?